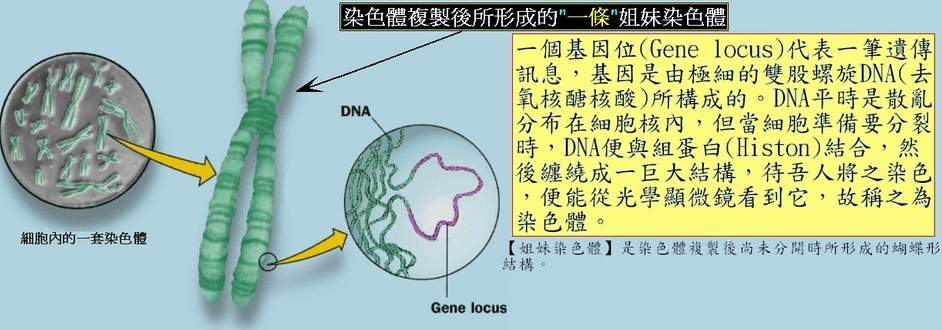
人類基因組
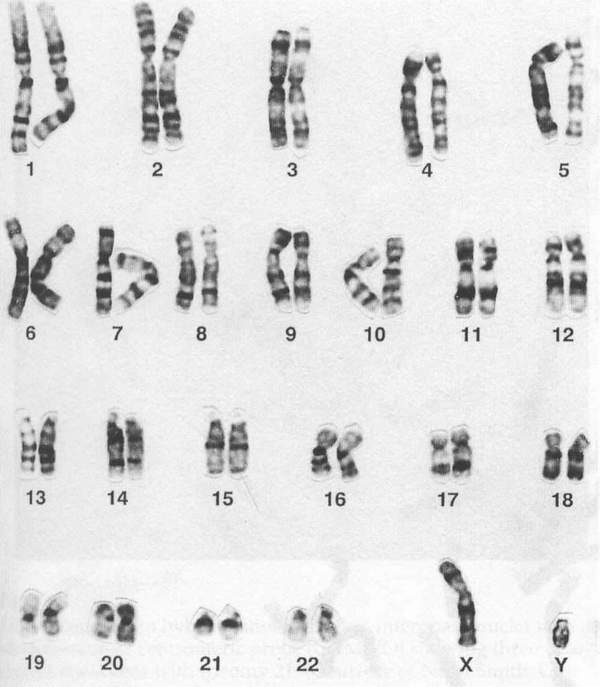
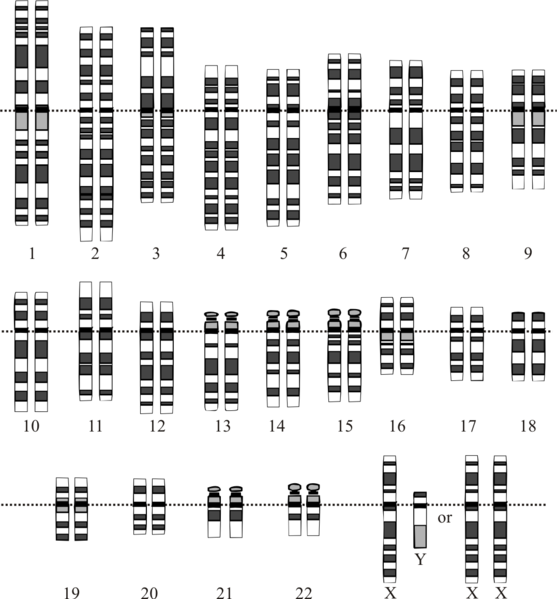
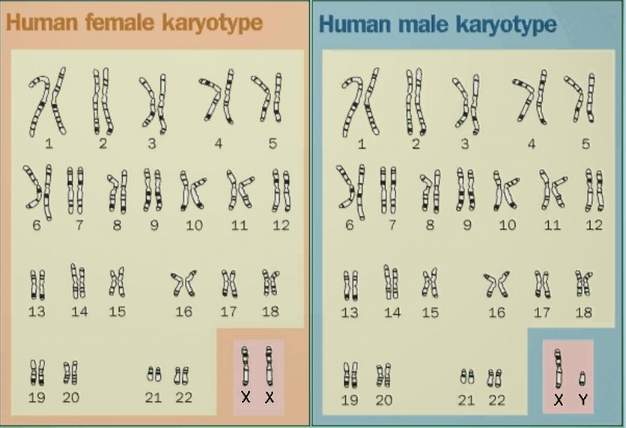
根據一般人類體細胞所擁有的染色體而繪製的「染色體組型圖」。
人類基因組,又稱人類基因體,是智慧人種的基因組,由24條染色體組成,
其中包括22條體染色體、1條X染色體和1條Y染色體。
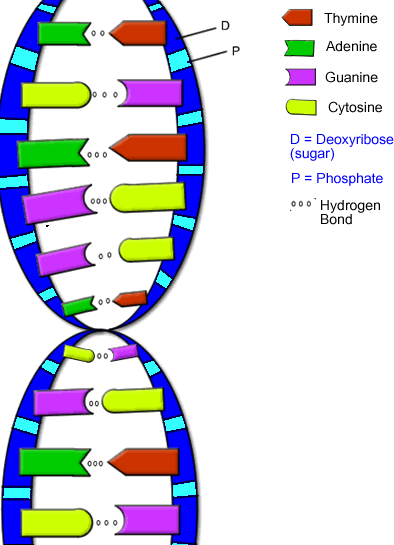
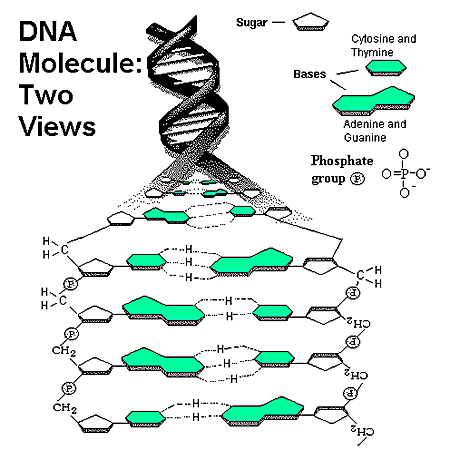
人類基因組含有約30億個DNA鹼基對,鹼基對是以氫鍵相結合的兩個含氮鹼基,
以胸腺嘧啶(A)、腺嘌呤(T)、胞嘧啶(C)和鳥嘌呤(G)四種鹼基排列成鹼基序列,
其中一部分的鹼基對組成了大約20000到25000個基因。
全世界的生物學與醫學界在人類基因組計畫中,調查人類基因組中的真染色質基因序列,
發現人類的基因數量比原先預期的少得多,其中的外顯子,也就是能夠製造蛋白質的編碼序列,只佔總長度的1.5%。
 |
 |
|
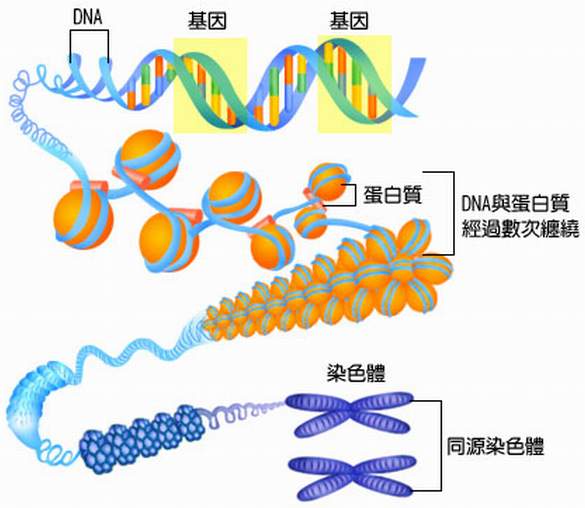
染色體
人類基因組是由23對染色體(共46個)所構成,每一個染色體皆含有數百個基因,在基因與基因之間,
會有一段可能含有調控序列和非編碼DNA的基因間區段。
人類擁有24種不同的染色體,其中有22個屬於體染色體,另外還有兩個能夠決定性別的性染色體,
分別是X染色體與Y染色體。
1號到22號染色體的編號順序,大致符合他們由大到小的尺寸排列。
最大的染色體約含有2億5千萬個鹼基對,最小的則約有3800萬個鹼基對。
這些染色體通常以細絲狀存於細胞核內,若將單一細胞內的染色體拉成直線,那麼將大約有6英尺長(1英尺=30.48公分)。
在人類個體的體細胞中,通常含有來自親代的1到22對體染色體,
再加上來自母親的X染色體,以及來自父親的X或Y染色體,
總共是46個(23對)染色體。
科學家將這些染色體分為6組:
1號到3號是A組;4號與5號是B組;
X染色體以及6號到12號是C組;13號到15號是D組;
16號到18號是E組;19號與20號是F組;
21號、22號與Y染色體是G組。
對於一般人類來說,每個細胞核內只有兩套染色體。
基因
人體內估計約有20000到25000個蛋白質編碼基因。
原本這個估計的數目超過100000,
在更好的基因組序列品質與基因識別技術出現之後,才逐漸向下修正為現在的數字。
雖然人類的基因數量比起某些較為原始的生物(如線蟲與果蠅)更少,
但是在人類細胞中使用了大量的選擇性剪接(alternative splicing;
將穿插在內含子中的外顯子以選擇性的方式進行轉錄),
這使得一個基因能夠製造出多種不同的蛋白質,
且人類的蛋白質組規模也較前述的兩個物種更龐大。
大多數人類基因擁有許多的外顯子,且人類的內含子比位在其兩端的外顯子更長。
這些基因參差不齊地分佈在染色體中,每一個染色體皆含有一些基因較多的區段與基因較少的區段。
這些區段的差異,則與染色體帶(chromosome bands)及GC含量相關。
基因密度所顯現的非隨機模式之涵義與重要性尚未明瞭。
除了蛋白質編碼基因之外,人類的基因組還包含了數千個RNA基因(製造非編碼RNA),其中包括用來轉錄轉運RNA(tRNA)、核糖體RNA(rRNA)與信使RNA(mRNA)的基因。其中轉錄rRNA的基因稱為rDNA,分佈在許多不同的染色體上。
調控序列
人類基因組含有許多不同的調控序列,並以此來控制基因表現。
這些序列是典型的短序列,會出現在靠近基因的位置。由於高通量表達(high-throughput expression;指利用電腦與機器輔助以進行大量的序列分析)技術與比較基因組學研究的出現,人們開始系統性地瞭解這些調控序列,以及它們共同構成的基因調控網路(gene regulatory network)。
人們之所以能夠出辨認哪些基因序列是調控序列,是因為生物在演化過程中對基因的保留。以大約7千萬年前到9千萬年前分支的人類與老鼠為例:
若以電腦比較兩者的基因序列,並且將兩者皆保有的非編碼序列辨識出來,就可以知道哪些基因序列可能對於基因調控來說相當重要。
人類所擁有的調控序列所在位置,可以利用河豚的基因定位出來。
因為河豚與人類擁有相同的基因,同時也擁有和人類相同的調控序列,但是「垃圾」基因比人類更少。
如此較為簡潔的DNA序列,使得調控基因的位置較容易定位。
其他DNA
蛋白質編碼序列(也就是外顯子)在人類基因組中少於1.5%。
在基因與調控序列之外,仍然有許多功能未知的廣大區域。
科學家估計這些區域在人類基因組中約佔有97%,
其中許多是屬於重複序列(repeated sequence)、
轉位子(transposon)與偽基因(pseudogene)。
除此之外,還有大量序列不屬於上述的已知分類。
這些序列大多數可能是演化的產物,現在已經沒有作用,
也因此有時會被稱作是「垃圾DNA」(junk DNA)。
不過有一些跡象顯示,這些序列可能會經由某些仍然未知的方式產生作用。
最近一些使用微陣列技術所作的實驗發現,大量非基因DNA事實上會被轉錄成為RNA,
這顯示轉錄作用背後可能還存在一些未知的機制。
此外,不同種類的哺乳動物在演化的過程中共同保留了這些序列,也顯示基因組中還有很多作用未知的部分。
人類基因組內大量功能未知的序列,是目前科學研究的重點之一。
變異
大多數對於人類遺傳變異的研究集中在單一核苷酸多型性(single nucleotide polymorphisms;SNPs),也就是DNA中的個別鹼基變換。科學家分析估計,在人類的真染色質(富含基因的染色質)中,平均每100到1000個鹼基會出現1個SNPs,不過密度並不均勻。
由於SNPs的存在,如「所有人類的基因有99%都是相同的」一的說法並不精確。
國際人類基因組單體型圖計劃(International HapMap Project),
便是爲了要將人類基因組中的SNP變異作編錄,而組成的一個大規模合作計畫。
基因組中有一些小型的重複序列,它們所擁有的基因座與基因長度,
在不同的人類個體之間有很大的變異性。
這也是DNA指紋(DNA fingerprinting)與親子鑑定(paternity testing)技術得以應用的基礎。異染色質(heterochromatin)是人類基因組的一些部分,
總共包括有數百萬個鹼基對,這些鹼基對在人類族群之中的變異性也相當大。
而且由於異染色質的重複性很高而且長度很長,
因此目前的技術仍然無法精確地解出它們的序列。
此外異染色質不含基因,對於表現型也沒有顯著的作用。
配子細胞中大多數的基因組突變,可能會造成胚胎不正常發育,而人類的一些疾病也與大尺度的基因組異常有關。
例如唐氏症、透納氏症(Turner Syndrome),以及許多其他疾病,是染色體的不分離(nondisjunction)現象所造成。
在癌細胞中的染色體,則是頻繁地出現非整倍性(aneuploidy)現象,不過這種現象與癌症之間的關係仍然不明。
2006年一篇發表在《自然》的研究報告中,研究人員發現在人類與其他哺乳類DNA序列中的拷貝數變異(copy number variation;CNV),可能非常重要。
拷貝數變異又稱為拷貝數多型性(copy number polymorphisms;CNPs),
是刪除、插入、複寫,以及複雜多位置變異(complex multi-site variants)的合稱,在所有人類以及其他已測試的哺乳動物中皆可發現。
遺傳疾病
當一個或多個基因發生不正常表現時,
便可能會使某個相對應的表型產生一些症狀。
遺傳異常的原因包括了基因突變、
染色體數目異常,
或是三聯體擴張重複突變(triplet expansion repeat mutations)。
如果受損的基因會從親代遺傳到子代,那就會成為一種遺傳性疾病。
目前已知有大約4000種遺傳疾病,囊腫性纖維化是其中最普遍的疾病之一。
科學家通常會以群體遺傳學的方法進行遺傳疾病的研究,
對於疾病的治療,則是由一些經過臨床遺傳學訓練,
且同時也是遺傳學家的醫生來進行。
人類基因組計畫的成果,
使遺傳檢測技術能夠更有效地檢查出一些與基因有關的疾病,
並且改進治療方法。
父母能夠透過遺傳諮詢來偵詢一些遺傳症狀的嚴重性、
遺傳的機率,以及如何避免或是改善這些症狀。
基因劑量(Gene dosage)會對人類的表現型產生龐大的影響,
對於染色體中造成疾病的複寫、省略與分裂等現象的形成擁有一定的角色。
例如唐氏症患者(21號染色體為三體)有較高的比率得到阿茲海默症,
可能是因為與阿茲海默症有關的類澱粉前趨蛋白基因(位在21號染色體上)
的過度表現所致。
而且相對而言,唐氏症患者中則有較低的比率得到乳癌,
可能是因為腫瘤抑制基因(tumor-suppressor gene)的過度表現。
 演化
演化
比較基因組學(Comparative genomics)對於哺乳類基因組的研究顯示,
人類與大約兩億年前就已經分化的各物種相比,
有大約5%的比例在人類基因組中保留了下來,其中包含許多的基因與調控序列。
而且人類與大多數已知的脊椎動物間,也享有了一些相同的基因。
黑猩猩的基因組與人類的基因組之間,有98.77%是相似的。
而平均每一個屬於人類的標準蛋白質編碼基因,
只與屬於黑猩猩的同源基因相差兩個氨基酸;
並且有將近三分之一的人類基因與黑猩猩的同源基因,能夠轉譯出相同的蛋白質。
人類的2號染色體,是人類與黑猩猩基因組之間的主要差異,
這一條染色體是由黑猩猩的染色體12號與13號融合而成。
人類在晚近的演化過程中失去了嗅覺受器基因,
這解釋了為何人類比起其他的哺乳動物來說,擁有較差的嗅覺。
演化上的證據顯示,人類與某些靈長類所擁有的彩色視覺,
降低了這些物種對於嗅覺能力的需求。
粒線體基因組
大多數的基因是存在細胞核中,但是細胞中一個稱為粒線體的胞器,
也擁有自己的基因組。粒線體基因組在粒線體疾病(mitochondrial disease)
中具有一定的重要性。而且這些基因也可以用來研究人類的演化,
舉例而言,若分析人類粒線體基因組的變異情況,
將能夠使科學家描繪出人類的共同祖先,稱為「粒線體夏娃」(Mitochondrial
Eve)。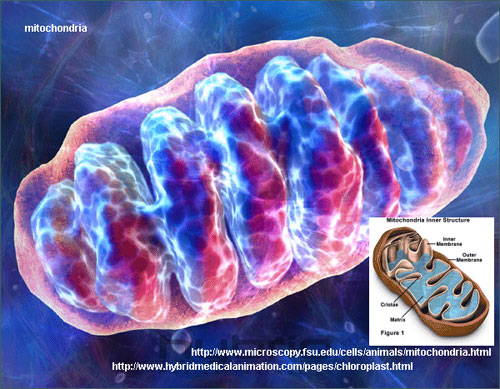
之所以稱為夏娃,
是因為粒線體是位於細胞質中,而人類的精子與卵子結合時,
源自母親(女性)的卵子提供了絕大多數的細胞質,
因此人類細胞中的粒線體基因皆是來自母親。
由於粒線體缺乏用來檢查複製錯誤的能力,
因此粒線體DNA(mDNA)的變異速率比細胞核DNA(一般所指的DNA)更快。
粒線體的突變速率快了20倍,這使mDNA能夠用來較為精確地追溯出母系祖先。
研究族群中的mDNA,也能使人們得知此族群過去的遷移路徑,
例如來自西伯利亞的美洲原住民;以及來自東南亞的波里尼西亞人。
更有甚者,mDNA研究顯示在歐洲人的基因中並無參雜尼安德塔人的DNA。
與每個細胞核皆只有兩套染色體組成的核基因組不同,
粒線體基因組在每個粒線體當中,皆有大約10個以環狀DNA,整個細胞裡則約有8000個。
每個環DNA上有16569個鹼基對,共組成37個基因,
其中13個是蛋白質編碼,22個是RNA基因。
這些基因大多與呼吸作用有關。

研究
人類基因組計畫
羅納德·杜爾貝科(Renato Dulbecco;主要研究基因與腫瘤的關係)是最早提出人類基因組定序的科學家之一。
他認為如果能夠知道所有人類基因的序列,
對於癌症的研究將會很有幫助。
不過以1986年的技術而言,若要將所有人類的DNA都定序完成,
需要花上1500年。
美國能源部(DOE)與美國國家衛生研究院(NIH),
分別在1986年與1987年加入人類基因組計畫。
除了美國之外,日本在1981年就已經開始研究相關問題,
但是並沒有美國那樣積極。
到了1988年,詹姆士·華生(DNA雙螺旋結構發現者之一)成為NIH的基因組部門主管。
1990年開始國際合作。1996年,多個國家招開百慕達會議,以2005年完成定序為目標,
分配了各國負責的工作,並且宣佈研究結果將會即時公佈,並完全免費。
1998年,克萊格·凡特的塞雷拉基因組公司成立,而且宣佈將在2001年完成定序工作。
 |
 |
隨後國際團隊也將完成工作的期限提前。2000年6月26日,塞雷拉公司的代表凡特,
以及國際合作團隊的代表法蘭西斯·柯林斯(Francis Collins),在美國總統柯林頓的陪同下發表演說,宣佈人類基因組的概要已經完成。
2001年2月,國際團隊與塞雷拉公司,分別將研究成果發表於《自然》與《科學》兩份期刊。
在基因組計畫的研究過程中,塞雷拉基因組使用的是霰彈槍定序法(shotgun sequencing),
這種方法較為迅速 ,但是仍需以傳統定序來分析細節。
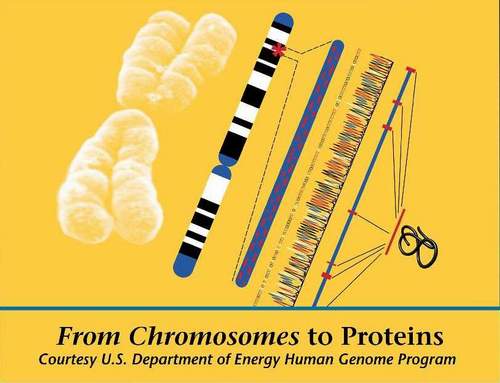
圖譜
基因組圖譜主要可以分成兩種,一種是遺傳圖譜(genetic map),另一種則是物理圖譜(physical map)。
遺傳圖譜是利用基因的重組率來做分析,單位是摩根(morgan)。
這種圖譜表現出來的是是基因或特定DNA片段之間的相對位置,而不是它們各自的絕對位置。
物理圖譜則是DNA兩點的實際距離,是實際將DNA片段排序而得,單位是鹼基的數目(如Kb;kilobase)。
有時候物理圖譜上相隔很遠的基因,可能會因為發生互換的機率較少(雖然理論上相隔愈遠互換率愈高),
而在遺傳圖譜上顯得較相近。
(維基百科)
人類基因組計畫 簡介 人類基因組計畫(human genome project, HGP)是由美國科學家于1985年率先提出,於1990年正式啟動的。 美國、英國、法蘭西共和國、德意志聯邦共和國、日本和我國科學家共同參與了這一價值達30億美元的人類基因組計畫。 這一計畫旨在為30多億個堿基對構成的人類基因組精確測序,發現所有人類基因並搞清其在染色體上的位置, 破譯人類全部遺傳信息。與曼哈頓原子彈計畫和阿波羅計畫並稱為三大科學計畫。
1986年,諾貝爾獎獲得者Renato Dulbecco發表短文《腫瘤研究的轉捩點: 人類基因組測序》(Science, 231: 1055-1056)。 文中指出:如果我們想更多地瞭解腫瘤,我們從現在起必須關注細胞的基因組。…… 從哪個物種著手努力? 如果我們想理解人類腫瘤,那就應從人類開始。……人類腫瘤研究將因對DNA的詳細知識而得到巨大推動。”
什麼是基因組(Genome)?基因組就是一個物種中所有基因的整體組成。 人類基因組有兩層意義:遺傳信息和遺傳物質。要揭開生命的奧秘,就需要從整體水準研究基因的存在、 基因的結構與功能、基因之間的相互關係。
為什麼選擇人類的基因組進行研究? 因為人類是在“進化”歷程上最高級的生物,對它的研究有助於認識自身、掌握生老病死規律、疾病的診斷和治療、瞭解生命的起源。
在人類基因組計畫中,還包括對五種生物基因組的研究: 大腸桿菌、酵母、線蟲、果蠅和小鼠,稱之為人類的五種“模式生物”。
HGP的目的是解碼生命、瞭解生命的起源、瞭解生命體生長發育的規律、認識種屬之間和個體之間存在差異的起因、 認識疾病產生的機制以及長壽與衰老等生命現象、為疾病的診治提供科學依據。
HGP的誕生和啟動 對人類基因組的研究在70年代已具有一定的雛形,在80年代在許多國家已形成一定規模。 1984年在Utah州的Alta,White R and Mendelsonhn M受美國能源部(DOE)的委託主持召開了一個小型專業會議討論 測定人類整個基因組的DNA序列的意義和前景(Cook Deegan RM,1989)…….. 1985年5月在加州Santa Cruz由美國DOE的Sinsheimer RL主持的會議上提出了測定人類基因組全序列的動議, 形成了美國能源部的“人類基因組計畫”草案。…….. 人類基因組計畫(Human genome project)由美國於1987年啟動,中共於1993年加入該計畫,承擔其中1%的任務, 即人類3號染色體短臂上約30Mb的測序任務。 2000年6月28日人類基因組工作草圖完成。由於人類基因測序和基因專利可能會帶來巨大的商業價值, 各國政府和一些企業都在積極地投入該項研究。 如1997年AMGE公司轉讓了一個與中樞神經疾病有關的基因而獲利3.92億美元。…
HGP的研究內容 HGP的主要任務是人類的DNA測序,包括下圖所示的四張譜圖,此外還有測序技術、人類基因組序列變異、 功能基因組技術、比較基因組學、社會、法律、倫理研究、生物資訊學和計算生物學、教育培訓等目的。
1、遺傳圖譜(genetic map) 又稱連鎖圖譜(linkage map),它是以具有遺傳多態性(在一個遺傳位點上具有一個以上的等位基因, 在群體中的出現頻率皆高於1%)的遺傳標記為“路標”,以遺傳學距離(在減數分裂事件中兩個位點之間進行交換、 重組的百分率,1%的重組率稱為1cM)為圖距的基因組圖。遺傳圖譜的建立為基因識別和完成基因定位創造了條件。
意義:6000多個遺傳標記已經能夠把人的基因組分成6000多個區域, 使得連鎖分析法可以找到某一致病的或表現型的基因與某一標記鄰近(緊密連鎖)的證據, 這樣可把這一基因定位於這一已知區域,再對基因進行分離和研究。 對於疾病而言,找基因和分析基因是個關鍵。
2、物理圖譜(physical map) 物理圖譜是指有關構成基因組的全部基因的排列和間距的資訊,它是通過對構成基因組的DNA分子進行測定而繪製的。 繪製物理圖譜的目的是把有關基因的遺傳信息及其在每條染色體上的相對位置線性而系統地排列出來。 DNA物理圖譜是指DNA鏈的限制性酶切片段的排列順序,即酶切片段在DNA鏈上的定位。 因限制性內切酶在DNA鏈上的切口是以特異序列為基礎的,核苷酸序列不同的DNA, 經酶切後就會產生不同長度的DNA片段,由此而構成獨特的酶切圖譜。 因此,DNA物理圖譜是DNA分子結構的特徵之一。 DNA是很大的分子,由限制酶產生的用於測序反應的DNA片段只是其中的極小部分, 這些片段在DNA鏈中所處的位置關係是應該首先解決的問題, 故DNA物理圖譜是順序測定的基礎,也可理解為指導DNA測序的藍圖。
3、序列圖譜 隨著遺傳圖譜和物理圖譜的完成,測序就成為重中之重的工作。 DNA序列分析技術是一個包括製備DNA片段化及堿基分析、DNA資訊翻譯的多階段的過程。 通過測序得到基因組的序列圖譜。
4、基因圖譜 基因圖譜是在識別基因組所包含的蛋白質編碼序列的基礎上繪製的結合有關基因序列、 位置及表達模式等資訊的圖譜。在人類基因組中鑒別出占具2%~5%長度的全部基因的位置、 結構與功能,最主要的方法是通過基因的表達產物mRNA反追到染色體的位置。
基因圖譜的意義:在於它能有效地反應在正常或受控條件中表達的全基因的時空圖。 通過這張圖可以瞭解某一基因在不同時間不同組織、不同水準的表達; 也可以瞭解一種組織中不同時間、不同基因中不同水準的表達, 還可以瞭解某一特定時間、不同組織中的不同基因不同水準的表達。
人類基因組是一個國際合作專案:表徵人類基因組,選擇的模式生物的DNA測序和作圖, 發展基因組研究的新技術,完善人類基因組研究涉及的倫理、法律和社會問題, 培訓能利用HGP發展起來的這些技術和資源進行生物學研究的科學家,促進人類健康。
HGP對人類的重要意義。 1、HGP對人類疾病基因研究的貢獻 人類疾病相關的基因是人類基因組中結構和功能完整性至關重要的資訊。 對於單基因病,採用“定位克隆”和“定位候選克隆”的全新思路,導致了亨廷頓舞蹈病、 遺傳性結腸癌和乳腺癌等一大批單基因遺傳病致病基因的發現,為這些疾病的基因診斷和基因治療奠定了基礎。 對於心血管疾病、腫瘤、糖尿病、神經精神類疾病(老年性癡呆、精神分裂症)、 自身免疫性疾病等多基因疾病是目前疾病基因研究的重點。 健康相關研究是HGP的重要組成部分,1997年相繼提出:“腫瘤基因組解剖計畫”“環境基因組學計畫”。
2、HGP對醫學的貢獻 基因診斷、基因治療和基於基因組知識的治療、基於基因組資訊的疾病預防、疾病易感基因的識別、 風險人群生活方式、環境因數的干預。 3、HGP對生物技術的貢獻 (1)基因工程藥物:分泌蛋白(多肽激素,生長因數,趨化因數,凝血和抗凝血因數等)及其受體。 (2)診斷和研究試劑產業:基因和抗體試劑盒、診斷和研究用生物晶片、疾病和篩藥模型。 (3)對細胞、胚胎、組織工程的推動:胚胎和成年期幹細胞、克隆技術、器官再造。
4、HGP對制藥工業的貢獻 篩選藥物的靶點:與組合化學和天然化合物分離技術結合,建立高通量的受體、 酶結合試驗以知識為基礎的藥物設計:基因蛋白產物的高級結構分析、預測、類比—藥物作用“口袋”。
5、HGP對社會經濟的重要影響 生物產業與資訊產業是一個國家的兩大經濟支柱;發現新功能基因的社會和經濟效益;轉基因食品; 轉基因藥物(如減肥藥,增高藥)
6、HGP對生物進化研究的影響: 生物的進化史,都刻寫在各基因組的“天書”上;草履蟲是人的親戚——13億年; 人是由300∼400萬年前的一種猴子進化來的;人類第一次“走出非洲”——200萬年的古猿; 人類的“夏娃”來自於非洲,距今20萬年——第二次“走出非洲”?
7、HGP帶來的負面作用 侏羅紀公園不只是科幻故事;種族選擇性滅絕性生化武器;基因專利戰;基因資源的掠奪戰;基因與個人隱私。
草圖的作用 1、草圖,許多疾病相關的基因被識別 2、SNP(人與人之間的區別),草圖提供了一個理解遺傳基礎和人類特徵進化的框架。 3、草圖後,研究人員有了新的工具來研究調節區和基因網路。 4、比較其他基因組可以揭示共同的調控元件,和其他物種共用的基因的環境, 也許提供在個體水準之上的關於功能和調節的資訊。 5、草圖同樣是研究基因組三維壓縮到細胞核中的一個起點。 這樣的壓縮可能影響到基因調控 6、在應用上,草圖資訊可以開發新的技術,如DNA晶片、蛋白質晶片,作為傳統方法的補充, 目前,這樣的晶片可以包含蛋白質家族中所有的成員,從而在特定的疾病組織中可以找到那些是活躍的。
2001年2月12日,美國Celera公司與人類基因組計畫分別在《科學》和《自然》雜誌上公佈了 人類基因組精細圖譜及其初步分析結果。 其中,政府資助的人類基因組計畫採取基因圖策略,而Celera公司採取了“鳥槍策略”。 至此,兩個不同的組織使用不同的方法都實現了他們共同的目標:完成對整個人類基因組的測序的工作; 並且,兩者的結果驚人的相似。 整個人類基因組測序工作的基本完成,為人類生命科學開闢了一個新紀元, 它對生命本質、人類進化、生物遺傳、個體差異、發病機制、疾病防治、新藥開發、健康長壽等領域, 以及對整個生物學都具有深遠的影響和重大意義,標誌著人類生命科學一個新時代的來臨。
眾多的發現 1、分析得知:全部人類基因組約有2.91Gbp,約有39000多個基因;平均的基因大小有27kbp; 其中G+C含量偏低,僅占38%,而2號染色體中G+C的含量最多; 到目前仍有9%的堿基對序列未被確定,19號染色體是含基因最豐富的染色體,而13號染色體含基因量最少等等。
2、目前已經發現和定位了26000多個功能基因,其中尚有42%的基因尚不知道功能, 在已知基因中酶占10.28%,核酸酶占7.5%,信號傳導占12.2%,轉錄因數占6.0%,信號分子占1.2%,受體分子占5.3%, 選擇性調節分子占3.2%,等。發現並瞭解這些功能基因的作用對於基因功能和新藥的篩選都具有重要的意義。
3、基因數量少得驚人:一些研究人員曾經預測人類約有14萬個基因, 但Celera公司將人類基因總數定在2.6383萬到3.9114萬個之間,不超過40,000, 只是線蟲或果蠅基因數量的兩倍,人有而鼠沒有的基因只有300個。 如此少的基因數目,而能產生如此複雜的功能,說明基因組的大小和基因的數量在生命進化上可能不具有特別重大的意義, 也說明人類的基因較其他生物體更'有效',人類某些基因的功能和控制蛋白質產生的能力與其他生物的不同。
這將對我們目前的許多觀念產生重大的挑戰,它為後基因組時代中生物醫學的發展提供新的非凡的機遇。 但由於基因剪切,EST資料庫的重複以及一些技術和方法上的誤差,將來亦可能人類的基因數會多於4萬。
4、人類單核苷酸多態性的比例約為1/1250bp,不同人群僅有140萬個核苷酸差異,人與人之間99.99%的基因密碼是相同的。 並且發現,來自不同人種的人比來自同一人種的人在基因上更為相似。在整個基因組序列中,人與人之間的變異僅為萬分之一, 從而說明人類不同“種屬”之間並沒有本質上的區別。
5、人類基因組中存在"熱點"和大片"荒漠"。 在染色體上有基因成簇密集分佈的區域, 也有大片的區域只有“無用DNA” ——不包含或含有極少基因的成分。基因組上大約有1/4的區域沒有基因的片段。 在所有的DNA中,只有1%-1.5%DNA能編碼蛋白,在人類基因組中98%以上序列都是所謂的“無用DNA”, 分佈著300多萬個長片斷重複序列。 這些重複的“無用”序列,決不是無用的,它一定蘊含著人類基因的新功能和奧秘,包含著人類演化和差異的資訊。 經典分子生物學認為一個基因只能表達一種蛋白質,而人體中存在著非常複雜繁多的蛋白質, 提示一個基因可以編碼多種蛋白質,蛋白質比基因具有更為重要的意義。
6、男性的基因突變率是女性的兩倍,而且大部分人類遺傳疾病是在Y染色體上進行的。 所以,可能男性在人類的遺傳中起著更重要的作用。
7、人類基因組中大約有200多個基因是來自于插入人類祖先基因組的細菌基因。 這種插入基因在無脊椎動物是很罕見的,說明是在人類進化晚期才插入我們基因組的。 可能是在我們人類的免疫防禦系統建立起來前,寄生於機體中的細菌在共生過程中發生了與人類基因組的基因交換。
8、發現了大約一百四十萬個單核苷酸多態性,並進行了精確的定位,初步確定了30多種致病基因。 隨著進一步分析,我們不僅可以確定遺傳病、腫瘤、心血管病、糖尿病等危害人類生命健康最嚴重疾病的致病基因, 尋找出個體化的防治藥物和方法,同時對進一步瞭解人類的進化產生重大的作用。
9、人類基因組編碼的全套蛋白質(蛋白質組)比無脊椎動物編碼的蛋白質組更複雜。 人類和其他脊椎動物重排了已有蛋白質的結構域,形成了新的結構。 也就是說人類的進化和特徵不僅靠產生全新的蛋白質,更重要的是要靠重排和擴展已有的蛋白質, 以實現蛋白質種類和功能的多樣性。有人推測一個基因平均可以編碼2-10種蛋白質,以適應人類複雜的功能。
模式生物:酵母(yeast)、大腸桿菌(Escherichia coli)、果蠅(Drosophila melanogaster)、線蟲(Caenorhabditis elegans)、 小鼠(Mus musculus)、擬南芥、水稻、玉米等等其他一些模式生物的基因組計畫也都相繼完成或正在順利進行。
目前基因組學的研究出現了幾個重心的轉移: 一是將已知基因的序列與功能聯繫在一起的功能基因組學研究; 二是從作圖為基礎的基因分離轉向以序列為基礎的基因分離; 三是從研究疾病的起因轉向探索發病機理;四是從疾病診斷轉向疾病易感性研究。
在後基因組時代,如果在已完成基因組測序的物種之間進行整體的比較、分析, 希望在整個基因組的規模上瞭解基因組和蛋白質組的功能意義,包括基因組的表達與調控、 基因組的多樣化和進化規律以及基因及其產物在生物體生長、發育、分化、行為、老化和治病過程中的作用機制 都必須發展新的演算法以充分利用超級電腦的超級計算能力。
美國和英國科學家2006年5月18日在英國《自然》雜誌網路版上發表了人類最後一個染色體——1號染色體的基因測序。 在人體全部22對常染色體中,1號染色體包含基因數量最多,達3141個,是平均水準的兩倍, 共有超過2.23億個堿基對,破譯難度也最大。一個由150名英國和美國科學家組成的團隊歷時10年,才完成了1號染色體的測序工作。 科學家不止一次宣佈人類基因組計畫完工,但推出的均不是全本,這一次殺青的“生命之書” 更為精確,覆蓋了人類基因組的99.99%。解讀人體基因密碼的“生命之書”宣告完成,歷時16年的人類基因組計畫書寫完了最後一個章節。 (節錄) (百度百科) |
|
遺傳疾病是如何遺傳
正常人類有46條染色體,即23對。第1道地22對染色體,一般稱之為「體染色體」,男女兩性均有, 其餘的2個染色體則是「性染色體」,男性是由一個X一個Y組成,女性是由兩個X組成。 每一條染色體上有數百至數千個基因,這些基因決定了一個人遺傳的特徵, 基因或染色體在數目和構造上的異常會導致先天畸型。
基因是決定個體遺傳自父母的特質,通常是成對出現的。 父母各提供一半,雖然有些特質是由一對基因控制,但有些特質,例如眼睛和頭髮的顏色,則是由很多對基因共同控制。 遺傳疾病可由基因(顯性遺傳、隱性遺傳或性連遺傳)、染色體異常及多因素遺傳等三種原因之一而形成。
1.多基因遺傳: 如唇顎裂、先天性心臟病、先天性髖關節脫臼、杵狀足、神經管缺陷等。 *由父母雙方各提供一些基因,加上環境的激發,造成病變的發生。
2.染色體異常遺傳疾病: 唐氏症(Down syndrome三染色體21症) 第21對染色體多一條、 巴陶氏症(Patau syndrome;三染色體13症) 第13對染色體多一條、 愛德華氏症(Edwards syndrome;三染色體18症) 第18對色體多一條、 特那氏症(Turner syndrome;X染色體症) 女生第23對少了一條X染色體、 柯林菲特氏症(Klinefelter syndrome) 男生第23對多了一條X染色體、 安裘曼氏症(Angelman syndrome;天使症) 第15對染色體長臂的缺損是來自母親染色體、 普瑞德-威利氏症(Prader- Willi syndrome;小胖威利症) 第15對染色體長臂的缺損是父親的染色體、 貓啼症(Cri du chat syndrome;Cat cry syndrome) 第5對染色體短臂部分缺失。 |
|
染色體異常
染色體構造上的異常可能會自然發生,亦會由物理及化學因子誘導而產生, 包括了缺失(deletion)、重複(duplication)、倒轉(inversion)、異位(translocation)。
(一)、缺失(deletion)
指生物的染色體上缺失了一段。會由熱、輻射線、病毒感染、化學因子、轉移子或重組脢發生錯誤引起。 可分端點缺失及中間缺失二種。 若於同源染色體上發生基因缺失,而造成另一條正常染色體的隱性顯現的現象稱為假顯性(pseudodominance), 例如一異質體Aa的個體,其中帶A基因的染色體部份缺落,結果使隱性基因a得以表現出來, 但二條染色體均發生缺失則大多造成生物體的死亡。
貓叫症(cri-du-chatsyndrome)便為人類因第5條染色體的短臂缺失而產生的疾病,此種患者哭聲似貓叫, 其不正常的叫聲是由於咽頭構造異常所造成,這種現象於出生後數週即可逐漸改善。 其他特點還包括出生時體重輕、生長及發育遲緩、智能不足、小頭、圓臉、低位耳、眼距過寬、肌肉緊結性低、 上眥贅皮、斷掌等。經常有餵食困難及呼吸道感染等問題。 這些病人生命期較短,智商通常不到30; 另一病例為第11對染色體缺失而產生,其表現型為腎臟病、智障、眼珠無虹膜。
(二)、重複(duplication)
是指染色體上某一段重複出現,此段可能連在原來的一段旁邊,或連在別條染色體上。 可能是因不相等的互換(unequalcrossingover)所造成,即因同源染色體配對不正確, 且其間發生互換,造成一條染色體發生缺失,另一條發生重複。 種類有前後重複、倒轉重複、移位重複,是以重複的那一段染色體連接的位置不同而定的。
其所造成的影響以果蠅的棒眼(bareye)最為代表,因果蠅眼睛大小的變化與基因的劑量(dose)有關, 而染色體發生重複的現象使基因的劑量增加,果蠅的眼睛是複眼,每隻眼睛由許多小眼組成, 正常的眼睛有779個小眼,於二條X染色體上各有一個16A區,棒眼則由較少的小眼組成。 隨著16A區因重複而增多,果蠅的眼睛便愈小。 有些CorneliadeLange症病人的第3條染色體之長臂會有一段出現重複的現象。
(三)、倒轉(inversion)
染色體的一段斷裂,轉180°後再重新接合,結果使基因的順序顛倒。 減數分裂前,染色體糾纏在一起可能形成一個圈環(loop),若圈環發生段裂經旋轉再接合就可能產生倒轉, 或是轉移子(transposon)的存在亦可能產生倒轉。 分為臂內倒轉及臂間倒轉,前者倒轉的一段不包含中心節,後者則含之。 減數分裂時,一條帶有倒轉的染色體,在與同源染色體配對時,為了達到「基因對基因」(genebygene)的原則, 帶有倒轉的染色體會纏繞成一圈,此稱倒轉圈(inversionloop)。
臂間倒轉的個體在減數分裂時,若於倒轉圈內發生互換,產生的配子存活率會降低。 臂內倒轉亦會如此,最後可能會產生一條雙中心節的染色體與一條無中心節的染色體,使產生的配子存活率會降低, 因而可能造成不孕、流產或畸胎等現象。 但小片段的倒轉有時不至於出現症狀。 倒轉在生物演化中是很常見的,一個種演化成另一個種,其間染色體可能有倒轉出現。 也可由生物種與種之間有倒轉現象,得知演化上的相關性。
(四)、異位(translocation)
染色體的一段由一位置移到另一個位置可能在同一條染色體內異位也可能轉移到不同一條染色體上。 可能自然發生或人工誘導,如以X光照射,有時會造成二、三或多對染色體間發生異位。 有相互異位及非相互異位二大類, 相互異位是兩條非同源染色體間各有一段互相交換位置; 非相互異位則是染色體的一段轉移到另一條非同源染色體上,但不互相交換。
於人類中有二異位之病例,一為羅氏異位(Robersoniantranslocation),此種患者發生非相互異位,染色體2N=45。 患者的兩條近端染色體,在中心節或接近中心節處發生斷裂產生二條長的染色體與二條短的染色體。 二條長的染色體融合成一條很長的中節染色體,二條短的染色體融合成一小條染色體片段, 此小段染色體在細胞分裂中會消失。
另一為異位唐氏症(translocationDown'ssyndrome)唐氏症患者是因第21條染色體有三條。 然而約4%的唐氏症患者又發生羅氏症,患者的第21條與第14、15或22條染色體間發生異位。 此外,慢性骨髓性白血病病患之白血球中可發現的"費城染色體",亦是異位的例子之一。 http://140.111.1.12/junior/bio/tc_wc/textbook/ch08/supply8-4-0.htm |
|
智能不足 周產期因素: 首先提到周產期因素,所謂周產期是指:產前、產中和產後、的相關時期。
產前會引起智能不足的因素有: (1)本身胎兒先天染色體異常或基因異常,或是腦部發育本身在胚胎發育時有異常; (2)母親本身嚴重感染,造成胎兒腦部發育受損,例如,巨細胞病毒、弓漿蟲症…等等; (3)母親酗酒、毒癮,亦會影響胎兒腦神經之發展。
至於產中,即是指生產的過程,是否有缺氧、窒息、產道感染、早產、胎兒呼吸窘迫、胎兒體重不足…等等 均會造成將來有智力受損的可能。
而產後則是指嬰兒腦部受傷、感染等意外事件。 以上種種情況都是會造成日後發展遲滯、智能不足的原因。 因此,除了先天染色體異常及基因異常之不可改變的事實外,其餘很多事件,均應盡全力來預防其發生。
染色體異常症
接下來談到染色體異常症。根據統計,一般活產嬰兒中約有百分之0.6會發生染色體異常症, 而異常的染色體往往造成病兒各式各樣的先天畸形,至於婦女早期流產的胎兒中就有更高的比例有染色體異常, 比例大約是百分之50到60,的確是相當的高。 近年來,遺傳學發展突飛猛進,使人類對染色體有更多更多的了解,以下讓我們來談談染色體異常症。
所謂染色體,可認為是遺傳物質,即基因的主要集合體。 人類正常的染色體數目是46,即23對。染色體異常症主要分為兩大類: 第一類是染色體「數目」上的異常,第二類是染色體「構造」上的異常。 其中,染色體數目上的異常是指病人的染色體數目比正常的46個增加或是減少; 而染色體構造上異常則是指某些染色體中的基因組脫失或增加了一部分。
此外,46個染色體中,屬於男女兩性均有的,則是第1到第22對染色體,即一般稱之為「常染色體」或「體染色體」, 其餘的2個染色體則是「性染色體」,男性是由一個X一個Y組成,而女性是由兩個X組成, 如果性染色體有異常,則也會造成遺傳物質有所變化,以下我們詳述之:
(1)、染色體數目異常 由於染色體數目異常經常會影響重要的基因,因此多半早已胎死腹中, 而在活產兒中最常見的常染色體數目異常則有: (1)唐氏症(21三染色體症);(2)18三染色體症;(3)13三染色體症。
另外,如為性染色體數目異常者,常見的則有: (1)透納氏症(45,X);(2)克林菲特氏症(47,XXY)。
(2)、染色體構造異常 另外,目前也漸漸為人所知,亦屬於常染色體異常的疾病是「普拉得-威利症候群」和「安琪曼症候群」, 此兩病均是屬於第15對染色體有斷裂或缺少一段所造成的智障疾病。
其中智障較輕微者是「普拉得-威利症候群」, 本病病患在出生前顯得胎動較少,出生後顯得張力低下、軟弱無力、吞嚥能力差,會令父母覺得是個難餵養的小孩子, 但在一歲之後反而會變得無法控制口腹之慾,很愛吃東西,接著愈來愈肥胖,且性腺的發育較差, 外生殖器顯得較不成熟,外官上看起來有明顯的杏仁狀眼、手腳顯得短小、肥胖及智能不足。
而在染色體上,可經由高解析度染色體分析發現,在病人的第15對染色體長臂上有一段缺失。 當然,經由分子遺傳學的方法也可做到基因的分析。
在相近的染色體區域上的異常,也會造成另一種嚴重的智障疾病,就是「安琪曼症候群」,也稱為「快樂木偶症」。 本病症病人有明顯不合宜的笑臉、不自如的手腳動作、而且幾乎都無語言的發展,有嚴重的智能不足, 檢定方法也是可經由高解析度染色體分析,或基因的分析來確定。
先天代謝異常
接著,提到先天代謝異常疾病方面,由於此類疾病多半是因為缺乏了某種生化代謝反應所需要的酵素, 或是缺少了反應所需的輔助因子所導致的,也由於體內的正常生化代謝反應被阻斷, 因此體內便堆積許多不正常的毒素和產物,對人體的神經和內臟就有了不多程度的傷害, 例如神經受傷後,智力就會受損。
而體內的生化代謝機轉非常繁複,有醣類代謝、氨基酸代謝、有機酸代謝、尿素循環等等。 這類疾病大部份都是以常染色體隱性遺傳或性連鎖遺傳的方式傳下去,也因為是隱性的疾病, 父母雙親均是隱性的帶原者,外表並無任何的異常,很難被發現。
通常都是在一對正常的夫妻下卻生下一個不正常的孩子後才被發現, 原來父母雙方均帶了一個不好的隱性基因,當然這對一個家庭的衝擊是非常大的。 雖然,醫學的進步目前已能對許多疾病進行偵測,但是不幸的是,我們並不可能對數千種的隱性疾病作全面的篩檢, 只能對已發生隱性疾病病例的家庭作進一步的診斷和有限的治療而已。 當然避免近親結婚的確減少帶有相同不好的隱性基因相遇的機會。
對於先天代謝異常疾病有一些特徵, 例如嬰兒出生時情況良好,但是一段時間後慢慢出現嘔吐、無力、昏迷、抽搐等異常現象, 或是有時在感染時誘發潛在的病情出現, 如果有這一類的情況發生,則應當考慮先天代謝異常症的可能性。
在本類疾病中,我特別提出一類目前大家較有印象的疾病,就是黏多醣貯積症,可細分為六個型, 但大致上本類病童外觀上會有大頭、粗眉、角膜混濁、面容粗糙無表情、聽力低下、寬扁鼻、大舌、厚唇、張嘴、 短頸、肝脾腫大、疝氣、駝背、關節僵硬、身材短小等變化。
單基因遺傳
首先是常染色體顯性遺傳的智障疾病-「結節性硬化症」。 本病是一種常見的引起抽搐和智障的疾病,根據統計約6000個新生兒就有一個, 但是實際上的發生率應較以上的數據更高,因為有些較輕微的病例較易被忽略。
本病的三大特徵就是包括抽搐、皮膚病變及程度不一的智障,至於其他的合併症包括體內許多器官的缺陷瘤, 例如心臟、腎臟方面的瘤變,而這些合併症常會致死。 本病在近十年來非常的熱門,研究發展也極為快速,由於臨床表現極多樣性,所以診斷不易; 而且雖然本病是遺傳性的,但是所有的病例中,卻只有三分之一是有家族病史, 另外三分之二均是新的突變造成的,因此更增加診斷的困難度。
以上所提的一些疾病,是僅就人類大約三千種遺傳疾病中,幾種最常見的且與智障有關的疾病做一敘述。 事實上,每個人體內約有十萬個基因,這是我們的遺傳物質,也寫滿了遺傳的密碼, 人類一直希望能解開上帝所寫下的生命的啞謎、解開疾病的因果。 近百年來,遺傳學從孟德爾神父觀察豌豆的性狀到今天基因工程的進步,已從最冷門的歷史變成最尖端的科學, 這實在是非常大的衝擊。 至於另一項「解讀人類基因地圖」的大計劃早已登場,預計在二十一世紀初期即會完成, 我們希望科學進步能帶給我們更好的診斷技術、更進步的產前檢驗、以及更完善的治療,以減少悲情的故事, 擺脫遺傳的宿命。(節錄) |
(10月20日完稿)