起死回生的神經幹細胞
現代醫學科技雖然發達,但對於神經損傷所造成的神經系統疾病,仍然沒有很好的治療方法。
例如車禍和運動傷害所導致的脊髓損傷及神經退化性疾病,像腦中風、帕金森氏症等,都會造成永久性的神經元死亡或缺損。
當神經系統無法再生新的神經元以維持神經網絡的正常聯繫時,身體的運動功能將難以恢複。
直到上個世紀,具有多向分化潛能的神經幹細胞培養出來後,神經生物學領域便有了重要的進展。
之後,更進一步發現腦組織內還存有這些具多向分化潛能的神經幹細胞,
這個重大發現打破了傳統認知中「神經系統損傷後不可再生」的觀念。
於是神經幹細胞的研究有了一個嶄新的契機,也就是「起死回生」的神經再生醫學。
一般認為動物體中樞神經系統的神經細胞,在出生前或出生後不久就不再產生,
這意味著成體動物的腦和脊髓內的神經細胞只會逐漸凋亡減少,無法再生或更新。
因此後天發生的中樞神經系統損傷不可能修復,神經功能的恢復只能依靠鄰近或其他中樞部位做結構上的代償。
1980 年代中期,美國洛克菲勒大學兩位學者在研究金絲雀的發聲學習行為中,
發現成年金絲雀腦中確實有新的神經細胞產生,且這些新的神經細胞能夠在前腦參與協調控制發聲學習的神經中樞,
但對於這些新生神經細胞的機轉還是未知。
直到 1992 年科學家才發現,在胚胎及成體中樞神經系統的室管膜下區,
有一群能自我更新、分裂增殖及分化成為大部分類型神經細胞的細胞群。
經體外實驗證實,這細胞群能聚集成大小不一的神經球,繼代培養若干次後,
便可分離得到神經幹細胞,而這是首次提出神經幹細胞的概念。
長期以來,科學家一直認為成體動物腦內神經細胞不具備更新能力,一旦受損乃至死亡將不可能再生,
這種觀點使帕金森氏症、阿茲海默氏症及腦脊髓損傷的治療受到了很大的限制。
雖然傳統藥物及外科手術治療有相當的進展,但是仍未能達到滿意的效果。
隨著對神經幹細胞的持續研究,新的進展可能會對治療上述中樞神經系統的疾病帶來新的契機。

神經細胞與神經幹細胞
神經組織包含兩種類型的細胞,即神經元及神經膠細胞。
神經元細胞包含一個細胞體及許多神經纖維的突起,可接受訊息並把它傳入稱為樹突的細胞體突起,
把訊息傳出細胞體的稱為軸突,因而神經元擔負起訊息的接收、整合及傳達的工作。
神經膠細胞則負責支持、保護神經元並提供營養,可分成星狀膠細胞、寡樹突細胞、小膠細胞、室管膜細胞及許旺氏細胞。
一般對神經幹細胞的定義,是指具有分化為神經元、星狀膠細胞和寡樹突細胞的能力,並能進行自我更新、分裂增殖,足以提供腦組織的細胞。
根據目前的研究發現,神經幹細胞主要存在於成體動物腦內多處,最主要分布在室管膜下區,緊鄰大腦的側腦室壁,
及海馬(hippocampus)的齒狀回,有極佳的神經再生能力。另外,從脊髓中也能分離出神經幹細胞。
迷人的特質
神經幹細胞之所以吸引人,是因為它具有幾項重要的特質。
首先,神經幹細胞有兩種不同的增生分裂特性。
一種是對稱分裂,即形成兩個相同的神經幹細胞來維持自身的存在。
另一種是非對稱分裂,其中一個子細胞不可逆地走向分化的終端,而成為功能專一的成熟細胞,
另一個子細胞則保留親代的特徵,仍做為神經幹細胞保留下來。
其次,神經幹細胞具遷移能力,它在體內的遷移受到多種因素的調控,
包括細胞本身成熟度、微環境狀態及細胞間的相互作用。
在進行神經幹細胞移植治療神經系統疾病時,神經幹細胞自身及周圍細胞所分泌的神經滋養因子、
蛋白質、介白質、神經化學物質與其代謝物等訊息表達的影響,
會引導新生或移植的神經幹細胞遷移到病變的區域,參與神經組織的代償、架構與功能性的修復。
此外,神經幹細胞也具有良好的組織融合性。
科學家發現把神經幹細胞移植到新生小鼠的腦皮質,經數周後觀察到這些外來神經幹細胞分化所得的細胞,
不僅具有神經元的典型形態和特異性表面標誌,而且長出的軸突不但能與周遭神經元形成廣泛的連結,
更能具備興奮性、抑制性傳輸,也能產生神經元特有的動作電位。
這說明了移植的神經幹細胞與宿主神經組織具有良好的融合性,
這些特點將可確保移植的神經幹細胞得以長期存活,並能達到與宿主神經組織聯繫的修復功能。
研發與應用
神經再生的契機,使得神經幹細胞的研究成為當今生命科學矚目的焦點之一。
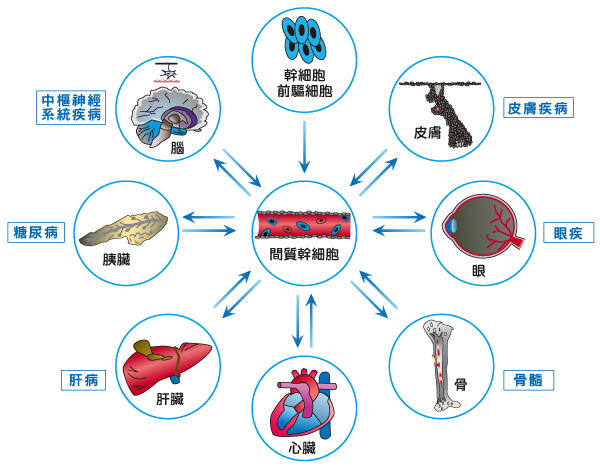
神經幹細胞在醫學上主要可應用在神經性退化疾病的治療、神經的再生與修復等,
例如脊髓受傷、腦中風、阿茲海默氏症、帕金森氏症、腦部創傷等病患是最有可能的受惠者。
在現在的研究中,也把神經幹細胞移植技術與基因治療結合, 利用具有特定基因工程載體的神經幹細胞為治療工具,
提供新的移植技術,
以提升神經幹細胞在再生醫學上的應用價值。
神經幹細胞在神經發育學和受損神經組織修復的研究中扮演著重要的角色,
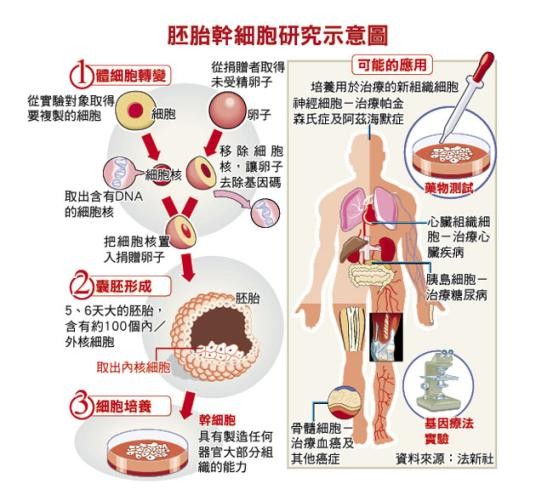
目前神經幹細胞的兩大研究主題之一是人類胚胎神經幹細胞,可以由多功能性的胚胎幹細胞分化而得。
胚胎幹細胞是一種原始細胞,可在體外分化成兩百種以上的人體器官與組織的細胞。
胚胎幹細胞具有良好的分化與自我更生的能力,在胚胎發育時期能發育成外胚層、中胚層及內胚層細胞。
單就學術研究而言,利用人類胚胎幹細胞來研究神經幹細胞,是最佳也是最終的選擇。
但由於目前取得來源是體外受精的卵子或墮胎的胎兒,相關社會倫理道德的疑慮有待克服,
另在實際操作上也遇到相當大的困難,這些都是必須面對的問題。
另一研究主題則集中在成體神經幹細胞,把部分分化、已分化或經由基因工程修飾的神經幹細胞移植到中樞神經系統,
或把處於靜止狀態下相關腦區的神經幹細胞誘導活化,使它們遷移到特定腦區,
發育成所需的神經元或神經膠細胞,以代償病變缺損的神經細胞。
由於神經幹細胞具有良好的組織融合性,因此以神經幹細胞做為基因載體,
除可用於顱內腫瘤和其他神經疾病的基因治療外,還可避免病毒載體的毒性與不良副作用。
此外,神經幹細胞的研究對於與神經相關藥物的開發、安全性和有效性等也有實用的價值。
因為在藥物開發過程中,可由特定幹細胞或幹細胞分化的專一細胞做為試驗的標的,
而不必進行耗時費力又昂貴的動物實驗,利用這項特性可開發出誘導或阻礙分化的醫療藥物。
基因治療理念
在新的研究發展理念中,以神經幹細胞的移植和基因治療應用為主,
這些研究以神經幹細胞做為神經系統疾病基因治療的載體,具有其他細胞移植所沒有的優勢。
首先,神經幹細胞植入宿主體內後,可直接進入並整合神經網絡,使治療基因的表達與微環境的調控連結,
且分化產生的神經細胞將逐漸代替有缺陷或死亡的神經細胞。
儘管神經幹細胞廣泛存在於神經系統,但是在移植治療選定移植標的區時,
還要考量到不同腦區神經幹細胞與膠原細胞的各自分化時機、微環境訊息等生物學特徵的調適,
才能提升移植後細胞的存活率,促進細胞間突觸的建立,並減低免疫排斥反應。
在臨床治療上,利用基因修飾的神經幹細胞有廣泛的應用前景,
但成功與否,仍依賴對影響神經幹細胞分化的因子能否有深入的了解。
同時,如何發展出簡便又有效的神經幹細胞體外增殖與特定神經元的大量誘導分化技術,都是解決問題的關鍵。