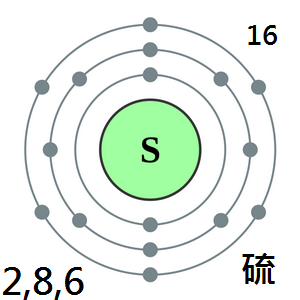
 硫是一種非金屬化學元素,化學符號S,原子序數16。
硫是一種非金屬化學元素,化學符號S,原子序數16。
硫
 硫是一種非金屬化學元素,化學符號S,原子序數16。
硫是一種非金屬化學元素,化學符號S,原子序數16。
硫是氧族元素之一,屬週期系VIA族,在元素週期表中位於第三週期。
硫的英文名為Sulfur,源自拉丁文的“surphur”,
傳說是來自印度的梵文“sulvere”,原義是鮮黃色。
指示硫的英文詞頭為“thio-”起源於希臘語中的“theion”(即硫磺),
釋義:一種非金屬元素,普通稱“硫磺”或“硫黃”,
可用以制火藥、火柴、殺蟲劑等,亦可用來治皮膚病。
通常單質硫是黃色的晶體,又稱作硫磺。
硫單質的同素異形體有很多種,有斜方硫、單斜硫和彈性硫等。
硫元素在自然界中硫元素以硫化物、硫酸鹽或單質硫形式存在。硫是人體內蛋白質的重要組成元素,
對人的生命活動具有重要意義。硫主要用於肥料、火藥、潤滑劑、殺蟲劑和抗真菌劑生產。
硫及含硫礦石燃燒生成的二氧化硫(S+O2==點燃==SO2)在空氣中與水和氧結合形成亞硫酸,
亞硫酸與空氣中的氧氣反應生成硫酸,從而造成硫酸型酸雨。
 發現歷史
發現歷史
硫在遠古時代就被人們所知曉。大約在4000年前,
埃及人已經會用硫燃燒所形成的二氧化硫來漂白布匹,
古希臘和古羅馬人也能熟練地使用二氧化硫來薰蒸消毒和漂白。
西元前九世紀,
古羅馬著名詩人荷馬在他的著作裏講述了硫燃燒時有消毒和漂白的作用。
硫在古代中國被列為重要的藥材,
在中國古代第一部藥物學專著《神農本草經》中
所記載的46種礦物藥品中, 就有石硫黃(即硫磺)。
在這部著作裏還指出:“石硫黃能化金銀銅鐵,奇物”。
這說明當時已經知曉硫能與銅、鐵等金屬直接作用而生成金屬硫化物。
世界現存最古的煉丹著作——魏伯陽的《周易參同契》,也記述了硫能和易揮發的汞化合成不易揮發的硫化汞。
在東晉煉丹家葛洪的《抱樸子內篇》中也有“丹砂燒之成水銀,積變又還成丹砂”的記載。
中國對火藥的研究,大概始於西元七世紀。
當時的火藥是黑火藥,它是由硝酸鉀、硫黃和木炭三者組成。
火藥的製造促進了硫磺的提取和精製技術的發展,《太清石壁記》有用昇華法精製硫磺的記載。
明朝末年宋應星的《天工開物》一書中對從黃鐵礦石和含煤黃鐵礦石制取硫磺的操作方法作了詳細的敍述。
隨著1746年英國J.Roebuck發明了鉛室法製造硫酸和1777年硫被法國 A.L.Lavoisier確認為一種元素後,硫便進入了近代化學的大門。
在此之後的年代,硫就迅速成為與近代化學工業和現代化學工業密切相關的最重要的元素之一。
含量分佈
硫在自然界中分佈較廣,在地殼中含量為0.048%(按品質計)。
在自然界中硫的存在形式有游離態和化合態。單質硫主要存在于火山周圍的地域中。
以化合態存在的硫多為礦物,可分為硫化物礦和硫酸鹽礦。
硫化物礦有黃鐵礦(FeS2)、黃銅礦(CuFeS2)、方鉛礦(PbS)、閃鋅礦(ZnS)等。
硫酸鹽礦有石膏(CaSO4·2H2O)、芒硝(Na2SO4·10H2O)、重晶石(BaSO4)、天青石(SrSO4)、
礬石[(AlO)2SO4·9H2O]、明礬石[K2SO4·Al2(SO4)3·24H2O]等。
物理性質
硫有25種同位素,其中四種是穩定的:S-32(95.02%)、S-33(0.75%)、S-34(4.21%)和S-35(0.02%),
除35S外,其他放射性同位素的半衰期都很短。硫-35由宇宙射線射擊空氣中的氬-40而導致,其半衰期為87.48年。
在森林生態系統中,硫酸鹽主要來自空氣,少量來自礦物的風化。其中硫的同位素的不同含量可用來確定它們的來歷。
 火山口處的硫
火山口處的硫
純的硫呈淺黃色,質地柔軟、輕,粉末有臭味。
硫不溶于水但溶於二硫化碳。
硫在所有的物態中(固態、液態和氣態),
硫都有不同的同素異形體,這些同素異形體的相互關係還沒有被完全理解。
晶體的硫可以組成一個由八個原子組成的環:S8。
導熱性和導電性都差。
性鬆脆,不溶于水。
無定形硫主要有彈性硫,是由熔態硫迅速傾倒在冰水中所得。
不穩定,可轉變為晶狀硫。
晶狀硫能溶於有機溶劑如二硫化碳(而彈性硫只能部分溶解)、四氯化碳和苯。
化合價有4種,為-2(硫化氫)、+2(硫代硫酸鈉)、+4(亞硫酸鈉)和+6(硫酸)價。
第一電離能10.360電子伏特。結晶形硫不溶于水,稍溶於乙醇和乙醚,溶於二硫化碳、四氯化碳和苯。
可轉變為晶狀硫(正交硫),正交硫是室溫下唯一穩定的硫的存在形式。原子半徑:88pm。
 化學性質
化學性質
單質硫有多種同素異形體。
單質硫的分子以環狀S8最為穩定,這種環狀分子中,
每個硫原子採取sp3不等性雜化,
與另外兩個硫原子之間以單鍵相連。
鍵長是206pm,內鍵角108°,兩個面之間的夾角是98°。
以S8環在空間的不同排列順序,
可以形成幾種硫的單質晶體,
其中最常見的是斜方硫和單斜硫。
斜方硫也稱作菱形硫或是α-硫,
它是室溫下唯一的穩定的硫的存在形式。
加熱到
單斜硫又稱作β-硫,在低於
單斜硫和斜方硫均能溶於CS2,C6H6等非極性溶劑。
也存在不穩定的環狀S6分子作為結構單元的硫單質。
加熱固體硫,熔化後氣化前,開環形成長鏈,若這時迅速冷卻,可以得到具有長鏈結構的有拉伸性的彈性硫。
硫可與變價金屬反應生成低價態金屬硫化物,
例如硫粉與鐵粉:Fe+S=△=FeS
硫粉與銅粉:
硫可與強氧化性酸反應:S+2H2SO4(濃)=△=3SO2+2H2O
硫與強鹼反應3S+6NaOH=△=2Na2S+Na2SO3+3H2O
同位素
硫有25種同位素,其中四種是穩定的:S-32(95.02%)、S-33(0.75%)、S-34(4.21%)和S-36(0.02%),
除35S外,其他放射性同位素的半衰期都很短。硫-35由宇宙射線射擊空氣中的氬-40而導致,其半衰期為87天。
制取方法
1.往二氧化硫中通入氫硫酸,可以制取硫。化學方程式:SO2+2H2S=3S↓+2H2O(氧化還原反應)[4]
2.往酸性高錳酸鉀中通入氫硫酸。化學方程式:2KMnO4+
5H2S+3H2SO4=K2SO4+2MnSO4+ 5S↓+ 8H2O
3.往亞硫酸中通入硫化氫。化學方程式:2H2S+H2SO3=3S↓+3H2O
 工業需求
工業需求
硫在工業中很重要,
比如作為電池中或溶液中的硫酸。
硫被用來製造火藥。在橡膠工業中做硫化劑。
硫還被用來殺真菌,用做化肥。
硫化物在造紙業中用來漂白。
硫酸鹽在煙火中也有用途。
硫代硫酸鈉和硫代硫酸氨在照相中做定影劑。
肥料。 製造硫酸、亞硫酸鹽、殺蟲劑、塑膠、搪瓷、
合成染料。橡膠硫化。漂白。藥物。油漆。
硫礦物最主要的用途是生產硫酸和硫磺。硫酸是耗硫大戶,中國約有70%以上的硫用於硫酸生產。
化肥是消費硫酸的最大戶,消費量占硫酸總量的70%以上,尤其是磷肥耗硫酸最多,增幅也最大。
硫酸除用於化學肥料外,還用於製作苯酚、硫酸鉀等90多種化工產品;
輕工系統的自行車、皮革行業;紡織系統的粘膠、纖維、維尼綸等產品;
冶金系統的鋼材酸洗、氟鹽生產部門;石油系統的原油加工、石油催化劑、添加劑以及醫藥工業等都離不開硫酸。
隨著中國經濟的發展,各行業對硫酸的需求量均呈緩慢上升趨勢,化肥用項是明顯的增長點。
高品位硫鐵礦燒渣可以回收鐵等;低品位的燒渣可作水泥配料。燒渣還可以回收少量的銀、金、銅、鋁、鋅和鈷等。
硫磺除為生產硫酸的原料之外,還廣泛用來生產化工產品,如硫化銅、焦亞硫酸鈉等。
另外,在食糖生產中,要把硫磺氧化為二氧化硫氣體用於漂白脫色。
在農藥生產中也直接或間接使用硫磺;粘膠纖維生產中需用二硫化碳作溶劑;
硫化金屬礦浮選用的藥劑要以二硫化碳為原料;
除以上應用外,消費硫磺的行業還有火柴製造、水泥枕軌處理、醫藥、火藥等。
比如作為電池中或溶液中的硫酸。硫被用來製造火藥。
硫也是生產橡膠製品的重要原料。硫還被用來殺真菌,用做化肥。
硫化物在造紙業中用來漂白。硫還可用於製造黑色火藥、焰火、火柴等。
硫代硫酸鈉和硫代硫酸氨在照相中做定影劑。
硫又是製造某些農藥(如石灰硫黃合劑)的原料。
生理作用
半胱氨酸、蛋氨酸、
同型半胱氨酸和牛磺酸等氨基酸和一些常見的酶含硫,
因此硫是所有細胞中必不可少的一種元素。
在蛋白質中,多肽之間的二硫鍵是蛋白質構造中的重要組成部分。
有些細菌在一些類似光合作用的過程中使用硫化氫作為電子提供物
(一般植物使用水來做這個作用)。
植物以硫酸鹽的形式吸收硫。
無機的硫是鐵硫蛋白的一個組成部分。
在細胞色素氧化酶中,硫是一個關鍵的組成部分。
醫療上,硫還可用來制硫黃軟膏醫治某些皮膚病,
但硫對身體危害較大長期在高含硫的工況下工工作對身體有極大損害。
危險性
工業硫磺為易燃固體。此外,空氣中含有一定濃度硫磺粉塵時不僅遇火會發生爆炸,
而且硫磺粉塵也很易帶靜電產生火花導致爆炸(硫磺粉塵爆炸下限為2.39/m),繼而燃燒引發火災。
按固體火災危險性分類硫磺屬於乙類,硫磺回收和成型裝置屬於火災危險性乙類裝置。
人體吸入硫磺粉塵後還會引起咳嗽、喉痛等。
燃燒爆炸危險性
①正常情況下燃燒緩慢,與氧化劑混合時燃燒速度劇增;
②與氧化劑混合可形成爆炸性混合物;
③遇明火、高溫易發生火災;
④粉塵易帶高達數千伏乃至上萬伏靜電;
⑤摩擦產生的高溫和明火等均可導致硫磺粉塵爆炸和火災;
⑥一般情況下硫磺粉塵比易燃氣體更易發生爆炸,但燃燒速度和爆炸壓力比易燃氣體小。
對人體危害
①因其可在腸內部分轉化為硫化氫而被人體吸收,故大量吞入(10~209)可導致硫化氫中毒;
②可引起眼結膜炎、皮膚濕疹,對皮膚有弱刺激性;③長期吸入硫磺粉塵一般無明顯毒性。