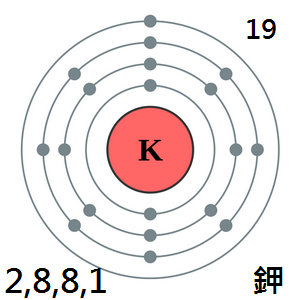
鉀

鉀是一種銀白色的軟質金屬,蠟狀,可用小刀切割,
熔沸點低,密度比水小,化學性質極度活潑(比鈉還活潑)。
是Ⅰ A族的元素之一,屬於鹼金屬。
鉀在自然界沒有單質形態存在,
鉀元素以鹽的形式廣泛的分佈于陸地和海洋中,
鉀也是人體肌肉組織和神經組織中的重要成分之一。
 歷史簡介
歷史簡介
鉀鹽以硝石(硝酸鉀,KNO3),
明礬(十二水合硫酸鋁鉀,KAl(SO4)2·12H2O),
還有草木灰(碳酸鉀,K2CO3)的形式已經被認知了幾個世紀。
它們被用於火藥,燃料和肥皂的製造。
把含鉀物質還原為元素挫敗了早期的化學家,
而且鉀被Antoine Lavoisier分類為“泥土”。
由於鉀的活動性很強,難以用常用的還原劑(如碳)
從鉀的化合物將金屬鉀還原出來。
之後在1807年,
韓弗理·大衛電解熔融氫氧化鉀發現有金屬小球形成,
這就是鉀。
 他注意到當把鉀扔到水裡時,
他注意到當把鉀扔到水裡時,
鉀會在水面上遊動,並燃燒發出美麗的紫色的火焰。
鉀的名稱來源於拉丁文Kalium,原意是“堿”。
拉丁文名稱從阿拉伯文Qali借來的。
中國科學家在命名此元素時,
因其活潑性在當時已知的金屬中居首位,
故用“金”旁加上表示首位的“甲”字
而造出“鉀”這個字。
物理性質
鉀為銀白色立方體結構金屬,理化性質和鈉非常相似。鉀質軟而輕可用小刀切割,新切面有銀白色光澤。
鉀表面常常為藍紫色、鉀的密度0.862g/cm3(293K),熔點336K(63℃),沸點1047K(774℃)。
鉀是熱和電的良導體,具有較好的導磁性,鉀鈉合金(液態)是核反應爐導熱劑。
鉀單質還具有良好的延展性,硬度也低,能夠溶於汞和液態氨,溶于液氨形成藍色溶液。
已發現的鉀的同位素共有28種,包括從鉀32至鉀55,其中在自然界中存在的只有鉀39、鉀40和鉀41,
其他同位素都是由人工製造。鉀40有放射性,是岩石和土壤中天然放射性本底的重要來源之一。
鉀離子能使火焰呈紫色,可用焰色反應和火焰光度計檢測。
 化學性質
化學性質
鉀的化學性質比鈉還要活潑,僅比銫、銣活動性差。
暴露在空氣中,表面迅速覆蓋一層氧化鉀和碳酸鉀,
使它失去金屬光澤(表面顯藍紫色),
因此金屬鉀應保存在液體石蠟或氬氣中以防止氧化。
鉀在空氣中加熱就會燃燒,它在有限量氧氣中加熱,
生成氧化鉀;在過量氧氣中加熱,
生成過氧化鉀和超氧化鉀的混合物;
金屬鉀溶于液氨生成深藍色液體,可導電,
實驗證明其中含氨合電子,
鉀的液氨溶液久置或在鐵的催化下會分解為氫氣和氨基鉀。
鉀的液氨溶液與氧氣作用,生成超氧化鉀,臭氧作用,生成臭氧化鉀。
鉀與水劇烈反應,甚至在冰上也能著火,生成氫氧化鉀和氫氣,反應時放出的熱量能使金屬鉀熔化,
並引起鉀和氫氣燃燒。鉀與氫、硫、氟、氯、溴、碘都能化合,可與低元醇反應放出氫氣。
鉀還能與汞形成鉀汞齊,是還原劑:K + Hg = K[Hg]。鉀和汞作用時會發生強烈的放熱反應。
鉀燃燒
鉀的常見氧化態為+1,但是也可以形成-1價的化合物,即鹼化物。在中國高中化學範疇認為鉀鹽均溶于水,
但實際上高氯酸鉀、酒石酸氫鉀、六氯鉑酸鉀、鈷亞硝酸鈉鉀、四苯硼酸鉀等溶解度均較小。
 化合物
化合物
氧化鉀
氧化鉀化學式K2O,分子量94.2,密度2.32g/cm3。
易潮解,易溶于水。為白色粉末,溶于水生成氫氧化鉀,並放出大量熱。
在空氣流中加熱能被氧化成過氧化鉀或超氧化鉀,
易吸收空氣中的二氧化碳成為碳酸鉀。
過氧化鉀
過氧化鉀,黃色無定形塊狀物,易潮解。
加熱分解,遇水放出氧氣,遇酸生成過氧化氫,
過氧化鉀能吸收二氧化碳並放出氧氣。
是強氧化劑。可由氫氧化鉀與過氧化氫反應制得。
超氧化鉀
超氧化鉀是一種一級氧化劑,在許多方面類似於第I族金屬過氧化物。
遇易燃物、有機物、還原劑等會引起燃燒甚至爆炸。
遇水或水蒸汽產生大量熱量,同樣可能發生爆炸。
吸濕性極強,與水激烈反應生成氧及可被進一步分解的鹼性過氧化物溶液。
氫氧化鉀
氫氧化鉀,白色粉末或片狀固體。具強鹼性及腐蝕性。
極易吸收空氣中水分而潮解,吸收二氧化碳而成碳酸鉀。
溶于水,能溶於乙醇和甘油。當溶解于水、醇或用酸處理時產生大量熱量。
0.1mol/L溶液的pH為13.5。相對密度2.044。熔點380℃(無水)。中等毒,有強腐性。
元素含量
地殼
鉀的化合物早就被人類利用,由於鉀的化學性質極為活潑,所以鉀在自然界中只以化合物形式存在。
人們古代就知道草木灰中存在著鉀草堿(即碳酸鉀),可用作洗滌劑。
硝酸鉀也被用作黑火藥的成分之一。
鉀在地殼中的含量為2.59%,占第七位。
可用來提取鉀鹽的礦物有鉀鹽礦(KCl)、光鹵石(KCl·MgCl2·6H₂O)、雜鹵石(2CaSO4·K₂SO4·2H₂O
)。
分佈極廣的天然矽酸鹽礦物中也含有鉀,如鉀長石K[AlSi3O8]。在雲母、鉀長石等矽酸鹽中都富含鉀。
海洋
在海水中以鉀離子的形式存在,含量約為0.1%。鉀在海水中含量比鈉離子少的原因是由於被土壤和植物吸收多。
在動植物體內也含有鉀。除了氧、氫、氯、鈉、鎂、硫、鈣之外,鉀在海水中的含量占第六位。
人體
正常人體內約含鉀175克,其中98%的鉀以鉀離子的形式貯存於細胞液內,是細胞內最主要的陽離子。
製備方法
生產金屬鈉用的是電解法,但在生產金屬鉀中卻不能用此法,因為鉀太容易溶解在熔化的KCl中,無法分離收集。
金屬鉀的生產方法採用金屬鈉與氯化鉀的反應:Na+KCl==高溫==K↑+NaCl。
鉀的沸點比鈉低,不斷地將鉀的蒸氣分離出去,就能使反應持續進行。
用真空蒸餾法可將鉀的純度提高為99.99%。
由於鉀比鈉貴, 在一般情況下都用鈉代替鉀,鉀鹽的用途就比較少,
但由於鉀鹽的吸濕性弱於鈉鹽,所以分析化學中常用鉀鹽做標準試劑。
主要用途
人體
鉀可以調節細胞內適宜的滲透壓和體液的酸堿平衡,參與細胞內糖和蛋白質的代謝。
有助於維持神經健康、心跳規律正常,可以預防中風,並協助肌肉正常收縮。
在攝入高鈉而導致高血壓時,鉀具有降血壓作用。
1.參與糖、蛋白質和能量代謝:糖原合成時,需要鉀與之一同進入細胞,糖原分解時,鉀又從細胞內釋出。
蛋白質合成時每克氮約需鉀3mmol,分解時,則釋出鉀。ATP形成時亦需要鉀。
2.
參與維持細胞內、外液的滲透壓和酸堿平衡:鉀是細胞內的主要陽離子,所以能維持細胞內液的滲透壓。
酸中毒時,由於腎臟排鉀量減少,以及鉀從細胞內向外移,所以血鉀往往同時升高,堿中毒時,情況相反。
3.
維持神經肌肉的興奮性。
4.
維持心肌功能:心肌細胞膜的電位變化主要動力之一是由於鉀離子的細胞內、外轉移。
人體鉀缺乏可引起心跳不規律和加速、心電圖異常、肌肉衰弱和煩躁,最後導致心跳停止。
一般而言,身體健康的人,會自動將多餘的鉀排出體外。但腎病患者則要特別留意,避免攝取過量的鉀。
在乳製品、水果、蔬菜、瘦肉、內臟、香蕉、葡萄乾中都含有豐富的鉀
人體缺鉀的主要症狀是:
心跳過速且心率不齊,肌肉無力、麻木、易怒、噁心、嘔吐、腹瀉、低血壓、精神錯亂、以及心理冷淡。[3]
植物
鉀能促進植株莖稈健壯,改善果實品質,增強植株抗寒能力,提高果實的糖分和維生素C的含量,和氮、磷的情況一樣,
缺鉀症狀首先出現于老葉。鉀素供應不足時,碳水化合物代謝受到干擾,光合作用受抑制,而呼吸作用加強。
因此,缺鉀時植株抗逆能力減弱,易受病害侵襲,果實品質下降,著色不良。
瓜、果、番茄等對鉀肥的需求主要是在果實迅速膨大期。
鉀肥一般是在基肥、沖施、追施、噴施和無圖營養栽培時施入,果實膨大前期沖施、
追施或葉面噴施0.5%磷酸二氫鉀、硝酸鉀、硫酸鉀、氯化鉀溶液。氯化鉀不能用於瓜類和煙葉。
鉀不足時,植株莖稈柔弱,易倒伏,抗寒性和抗旱性均差;葉片變黃,逐漸壞死。
由於鉀能移動到嫩葉,缺鉀開始在較老的葉,後來發展到植株基部,也有葉緣枯焦,葉子彎卷或皺縮。
1、促進酶的活化。
生物體中有60多種酶需要鉀離子作為活化劑。
2、促進光能的利用,增強光合作用。
首先K+能保持葉綠體內類囊體膜的正常結構,缺K+時類囊體膜結構鬆散,影響光合作用的正常進行。
同時又能促進類囊體膜上質子梯度的形成和光合磷酸化作用。
3、有利於植物正常的呼吸作用,改善能量代謝。
4、增強植株體內物質的合成和轉運。比如,碳水化合物的合成與運轉;
增強蛋白質與核蛋白的合成;促進豆科植物根瘤菌的固氮作用。
5、增強植物的抗性。
①、增強抗凍性、抗旱、抗鹽的能力;
②、增強植物對病蟲害的抗性。試驗表明,增施適量的鉀肥,
能有效地減少水稻的胡麻葉斑病、稻瘟病、紋枯病等;麥類的白粉病、赤黴病及小麥的銹病等等。
③、減少水稻受還原性物質的危害。