 鋯(Zirconium)是一種化學元素,
鋯(Zirconium)是一種化學元素,
鋯
 鋯(Zirconium)是一種化學元素,
鋯(Zirconium)是一種化學元素,
它的化學符號是Zr,
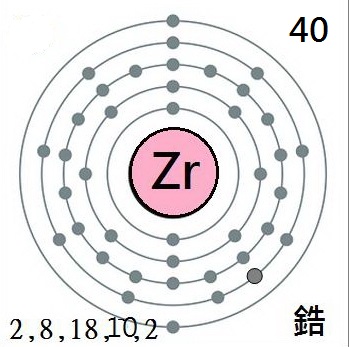
它的原子序數是40,
是一種銀白色的高熔點金屬之一,呈淺灰色。
密度6.49克/立方釐米。
熔點1852±2℃,沸點4377℃。
化合價+2、+3和+4。
第一電離能6.84電子伏特。
鋯的表面易形成一層氧化膜,
具有光澤,故外觀與鋼相似。
有耐腐蝕性,可溶于氫氟酸和王水;
高溫時,可與非金屬元素和許多金屬元素反應,生成固體溶液化合物。
鋯
⒈一種金屬元素,應用於原子能工業和在高溫高壓下用作耐蝕化工材料等。
⒈ 一種鋼灰色、強延性、難熔、 主要呈四價的金屬元素, 以化合物形式廣泛存在于鋯石
和二氧化鋯礦中
[zirconium]——元素符號Zr
 簡介
簡介
鋯,原子序數40,原子量91.224。
1789年德國化學家克拉普羅斯在鋯石中發現鋯的氧化物。
並根據鋯石的英文名命名;
1824年瑞典化學家貝采利烏斯首次制的不純的金屬鋯;
1925年荷蘭科學家阿克爾和德博爾制得有延展性的塊狀金屬鋯。
鋯在地殼中的含量為0.025%,
但分佈非常分散,主要礦物有鋯石和二氧化鋯礦。
天然鋯有6種穩定同位素:
鋯90、91、92、94、96,其中鋯90含量最大。
鋯為銀灰色金屬,外觀似鋼,有光澤;熔點1852°C,沸點4377°C,密度6.49克/釐米。
鋯容易吸收氫、氮和氧氣;鋯對氧的親和力很強,1000°C氧氣溶於鋯中能使
 其體積顯著增加。
鋯一般被認為是稀有金屬,
其體積顯著增加。
鋯一般被認為是稀有金屬,
其實它在地殼中的含量相當大,
比一般的常用的金屬鋅、銅、錫等都大。
鋯合金可以耐很高的溫度, 用作製作核反應的第一層保護殼。
鋯的表面易形成一層氧化膜,
具有光澤,故外觀與鋼相似。
有耐腐蝕性,但是溶于氫氟酸和王水; 高溫時,可與非金屬元素
和許多金屬元素反應,生成固溶體。
鋯的可塑性好,易於加工成板、絲等。
鋯在加熱時能大量地吸收氧、氫、氮等氣體,可用作貯氫材料。
鋯的耐腐蝕性比鈦好,接近鈮、鉭。
鋯與鉿是化學性質相似、又共生在一起的兩個金屬,
且含有放射性物質。
地殼中鋯的含量居第19位,幾乎與鉻相等。自然界中具有工業價值的含鋯礦物,主要有鋯英石及斜鋯石。
歷史簡介
包含鋯的寶石作為鋯石的形式在古代就已知了。
在1789年,德國化學家Martin Klaproth分析了一塊鋯石,並分離出了鋯的“泥土”形式氧化鋯,也就是氧化物ZrO2。
Klaproth沒能夠獨立出純淨的金屬本身,在1808年,Humphry
Davy試圖用電解法獲取也沒能成功。
直到1824年這個元素才被獨立出來,當瑞典化學家Jöns Berzelius加熱六氟鋯酸鉀(K2ZrF6)
和鉀金屬後獲得了黑色粉末狀的鋯。
完全純淨的鋯在1925年才被荷蘭化學家Anton Eduard van
Arkel和Jan Hendrik de Boer,
由分解四碘化鋯(ZrI4)制取。現在這種金屬由鎂加熱四氯化鋯來大量生產。
歷史
含鋯的天然矽酸鹽ZrSiO4稱為鋯石(Zircon)或風信子石(hyacinth)廣泛分佈於自然界中,
具有從橙到紅的各種美麗的顏色,自古以來被認為是寶石,據說Zircon一詞來自阿拉伯文Zarqūn,是朱砂,
又說是來自波斯文Zargun,是金色,hyacinth則來自希臘文的“百合花”一詞,印度洋中的島國斯里蘭卡盛產鋯石。
1789年德國人M.H.Klaproth對鋯石進行研究時發現,將它與氫氧化鈉共熔,用鹽酸溶解冷卻物,
在溶液中添加碳酸鉀,沉澱,過濾並清洗沉澱物,再將沉澱物與硫酸共煮,然後濾去矽的氧化物,
在濾液中檢查鈣、鎂、鋁的氧化物,均未發現,在溶液中添加碳酸鉀後出現沉澱,
這個沉澱物不像氧化鋁那樣溶於堿液,也不像鎂的氧化物那樣和酸作用,
Klaproth認為這個沉澱物和以前所知的氧化物都不一樣,
是由Zirkonerde(鋯土,德文)構成的,
不久,法國化學家de Morueau和Vauquelin兩人都證實M.H.Klaproth的分析是正確的,
該元素拉丁名為Zirconium,符號認為Zr,中國譯成鋯,
1808年,英國的H.Davy利用電流分解鋯的化合物,沒有成功。
1824年瑞典的J.J.Berzelius首先用鉀還原K2ZrF6時制得金屬鋯,但不夠純,
反應式為:K2ZrF6+4K=Zr+6KF,該反應也可用Na作還原劑,
直到1914年,荷蘭一家金屬白熱電燈製造廠的兩位研究人員Lely和Ham bruger用無水四氯化鋯和過量金屬鈉同盛入一空球中,
利用電流加熱500℃,取得了純金屬鋯。
 鋯合金
鋯合金
鋯合金以鋯為基體加入其他元素而構成的有色合金。
主要合金元素有錫、鈮、鐵等。
鋯合金在300~400℃的高溫高壓水和蒸汽中有良好的耐蝕性能、
適中的力學性能、較低的原子熱中子吸收截面,
對核燃料有良好的相容性,
多用作水冷核反應爐的堆芯結構材料。
此外,鋯對多種酸、堿和鹽有優良的抗蝕性,
與氧、氮等氣體有強烈的親和力,
因此鋯合金也用於製造耐蝕部件和製藥機械部件,
在電真空和燈泡工業中被廣泛用作非蒸散型消氣劑。
工業規模生產的鋯合金有鋯錫系和鋯鈮系兩類。前者合金牌號有Zr-2、Zr-4,後者的典型代表是
Zr-2.5Nb。
在鋯錫系合金中,合金元素錫、鐵、鉻、鎳可提高材料的強度、耐蝕性和耐蝕膜的導熱性,
降低表面狀態對腐蝕的敏感性。通常Zr-2合金用於沸水堆 ,Zr-4
合金用於壓水堆。
在鋯鈮系合金中,鈮的添加量達到使用溫度下鋯的晶體結構的固溶極限時,合金的耐蝕性最好。
鋯合金有同質異晶轉變,高溫下的晶體結構為體心立方,低溫下為密排六方。
鋯合金塑性好,可通過塑性加工製成管材、板材、棒材和絲材;其焊接性也好,可用以進行焊接加工。
 氧化鋯
氧化鋯
氧化鋯(ZrO₂)是自然界的礦物原料,
主要有斜鋯石和鋯英石。
鋯英石系火成岩深層礦物,
顏色有淡黃、棕黃、黃綠等,
比重4.6—4.7,硬度7.5,
具有強烈的金屬光澤,可為陶瓷釉用原料。
純的氧化鋯是一種高級耐火原料,
其熔融溫度約為2900℃它可提高釉的高溫粘度和擴大粘度變化的溫度範圍,
有較好的熱穩定性,
其含量為2%-3%時,能提高釉的抗龜裂性能。
還因它的化學惰性大,故能提高釉的化學穩定性和耐酸堿能力,還能起到乳濁劑的作用。
在建築陶瓷釉料中多使用鋯英石,一般用量為8%—12%。
並為“釉下白”的主要原料,氧化鋯為黃綠色顏料良好的助色劑,若想獲得較好的釩鋯黃顏料必須選用質純的氧化鋯。
氧化鋯還是一種理想的陶瓷原料,所生產氧化鋯陶瓷被廣泛用於航太航空、
機械製造、光纖通訊、鐘錶飾品、醫療器械、刀具餐具等領域,有著廣闊的發展空間。
矽酸鋯
Zr(SiO4),折射率高1.93-2.01,化學穩定性能,是一種優質、價廉的乳濁劑,
被廣泛用於各種建築陶瓷、衛生陶瓷、日用陶瓷、一級工藝品陶瓷等的生產中,
在陶瓷釉料的加工生產中,使用範圍廣,應用量大。
矽酸鋯之所以在陶瓷生產中得以廣泛應用,還因為其化學穩定性好,因而不受陶瓷燒成氣氛的影響,
且能顯著改善陶瓷的坯釉結合性能,提高陶瓷釉面硬度。
矽酸鋯也在電視行業的彩色顯像管、玻璃行業的乳化玻璃、搪瓷釉料生產中得到了進一步的應用。
矽酸鋯的熔點高:2500攝氏度,所以在耐火材料、玻璃窯爐鋯搗打料、澆注料、噴塗料中也被廣泛應用。
鋯指數
Zr index,後處理工藝中用來衡量溶劑降解程度的指標。
95Zr是一種重要的裂片,降解後的溶劑對95Zr具有高選擇性的保留作用,鋯指數越大,溶劑降解越嚴重。
鋯指數(Z值)的測量方法是:反萃後有機相經氫氧化鈉、水和硝酸洗滌後,用示蹤量95Zr水相與之平衡,
用3mol/L硝酸洗有機相3次,除去TBP萃取的95Zr。
測定溶劑相中被保留的鋯量,每109L溶劑保留的95Zr的摩爾數為溶劑的Z值。
由於鋯在水溶液中行為複雜,隨測量條件不同,Z值會不同,因而常用不穩定係數來表徵溶劑的穩定性:
戈德堡-霍格內斯盒。
用途
鋯的熱中子俘獲截面小,有突出的核性能,是發展原子能工業不可缺少的材料,可作反應堆芯結構材料。
鋯粉在空氣中易燃燒,可作引爆雷管及無煙火藥。
鋯可用於優質鋼去氧去硫的添加劑,也是裝甲鋼、大炮用鋼、不銹鋼及耐熱鋼的組元。
鋯是鎂合金的重要合金元素,能提高鎂合抗拉強度和加工性能。
鋯還是鋁鎂合金的變質劑,能細化晶粒。二氧化鋯和鋯英石是耐火材料中最有價值的化合物。
二氧化鋯是新型陶瓷的主要材料,不可用作抗高溫氧化的加熱材料。
二氧化鋯可作耐酸搪瓷、玻璃的添加劑,能顯著提高玻璃的彈性、化學穩定性及耐熱性。
鋯英石的光反射性能強、熱穩定性好,在陶瓷和玻璃中可作遮光劑使用。
鋯在加熱時能大量地吸收氧、氫、氨等氣體,是理想的吸氣劑,
如電子管中用鋯粉作除氣劑,用鋯絲鋯片作柵極支架、陽極支架等。
粉末狀鐵與硝酸鋯混合,可作閃光粉。金屬鋯幾乎全部用作核反應爐中鈾燃料元件的包殼。
也用來製造照相用的閃光燈,以及耐腐蝕的容器和管道,特別是能耐鹽酸和硫酸。
鋯的化學藥品可作聚合物的交聯劑。
軍事用途
從軍工上來看,鋼裡只要加進千分之一的鋯,硬度和強度就會驚人地提高。
含鋯的裝甲鋼、大炮鍛件鋼、不銹鋼和耐熱鋼等是製造裝甲車、坦克、大炮和防彈板等武器的重要材料。
從原子能和核能上來看,鋯有突出的核能性,是發展原子能工業不可缺少的材料,
中國的大型核電站普遍都用鋯材,如果用核動力發電,每一百萬千瓦的發電能力,
一年就要消耗掉20到25噸金屬鋯。
一艘三萬馬力的核潛艇所用的鋯合金作核燃料的包套和壓力管,使用量即可達20至30噸。
鋯是一種稀有金屬,具有驚人的抗腐蝕性能、極高的熔點、超高的硬度和強度等特性,
被廣泛用在航空航太、軍工、核反應、原子能領域。
“神六”上使用的抗腐蝕性、耐高的鈦產品,其抗腐蝕性能遠不如鋯,其熔點1600度左右,
而鋯的熔點則在1800度以上,二氧化鋯的熔點更是高達2700度以上,
所以鋯作為航空航太材料,其各方面的性能大大優越於鈦。
吸氣劑
在我們結識鋰和鈦的時候,知道它都有愛跟氣體“交朋友”的怪脾氣。
鋯也有這個脾氣,它能強烈地吸收氮、氫、氧等氣體。比方說,溫度超過攝氏九百度,鋯能猛烈地吸收氮氣;
在攝氏二百度的條件下,一百克金屬鋯能夠吸收八百一十七升氫氣,相當於鐵的八十多萬倍。
鋯的這個怪脾氣,給冶煉它的工人師傅們造成了很大的麻煩,
但是,在另外一些場合它又能給人們帶來好處。
比如在電真空工業中,人們廣泛利用鋯粉塗在電真空元件和儀錶的陽極和其他受熱部件的表面上,
吸收真空管中的殘餘氣體,製成高度真空的電子管和其他電真空儀錶,從而提高它們的品質,延長它們的使用時間。
冶金作用
鋯還可以用做冶金工業的“維生素”,發揮它強有力的去氧、除氮、去硫的作用。
鋼裡只要加進千分之一的鋯,硬度和強度就會驚人地提高;
含鋯的裝甲鋼、不銹鋼和耐熱鋼等,是製造裝甲車、坦克、大炮和防彈板等國防武器的重要材料。
把鋯摻進銅裡,抽鹹銅線,導電能力並不減弱,而熔點卻大大提高,用做高壓電線非常合適。
含鋯的鋅鎂合金,又輕又耐高溫,強度是普通鎂合金的兩倍,可用到噴氣發動機構件的製造上。
另外,鋯粉的特點是著火點低和燃燒速度快,可以用做起爆雷管的起爆藥,這種高級雷管甚至在水下也能夠爆炸。
鋯粉再加上氧化劑。這好比火上加油,燃燒起來強光眩目,是製造曳光彈和照明彈的好材料。