 鈮(niobium)是一種化學元素。
鈮(niobium)是一種化學元素。
鈮
 鈮(niobium)是一種化學元素。
鈮(niobium)是一種化學元素。
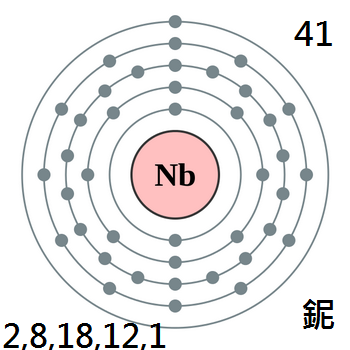
化學符號Nb,原子序數41,
原子量92.90638,屬週期系ⅤB族。
1801年英國C.哈切特從鈮鐵礦中
分離出一種新元素的氧化物,
並命名該元素為columbium(中譯名鈳)。
元素資訊
一種金屬元素。
鈮能吸收氣體,用作除氣劑,
也是一種良好的超導體。舊稱“鈳”。
化學符號Nb,原子序數41,原子量92.90638,屬週期系ⅤB族。
1801年英國查理斯·哈切特(Charles·Hatchett)在研究倫敦大英博物館中收藏的鈮鐵礦中分離出一種新元素的氧化物,
並命名該元素為columbium(中譯名鈳)。
 1802年瑞典A.G.厄克貝裡在鉭鐵礦中發現另一種新元素
tantalum。
1802年瑞典A.G.厄克貝裡在鉭鐵礦中發現另一種新元素
tantalum。
由於這兩種元素性質上非常相似,
不少人認為它們是同一種元素。
由於它與鉭非常相似,起初他竟搞混了。
1844年德意志H.羅澤詳細研究了許多鈮鐵礦和鉭鐵礦,
分離出兩種元素,才澄清了事實真相。
最後查理斯·哈切特用神話中的女神
尼俄伯(Niobe)的名字命名了該元素。
在歷史上,最初人們用鈮所在的鈮鐵礦的名字
“columbium”來稱呼鈮。
鈮在地殼中的含量為0.002%,鈮在地殼中的自然儲量為520萬噸,可開採儲量440萬噸,
主要礦物有鈮鐵礦〔(Fe,Mn)(Nb,Ta)2Ob〕、燒綠石〔(Ca,Na)2(Nb,Ta,Ti)2O6(OH,F)〕
和黑稀金礦、褐釔鈮礦、鉭鐵礦、鈦鈮鈣鈰礦。
歷史簡介
 當於1801年考察在大英博物館的礦石時,
當於1801年考察在大英博物館的礦石時,
Charles
Hatchett被一個標籤為columbite(鈳鐵礦)的樣本激起了興趣。
他推測其包含一種新的金屬,他是對的。
他加熱一塊樣本與碳酸鉀,溶解產物到水中,
添加了酸後獲得了沉澱物。
然而,進一步的處理也沒能生產出元素本身,
他命名其為columbium(鈳——鈮元素的舊譯),
被人們已知多年。
其他人對則對鈳持懷疑態度,
尤其是在接下來的一年發現了鉭之後。
這些金屬在大自然中一起出現,而且很難分離。
在1844年德國化學家Heinrich Rose證明了鈳鐵礦包含了這兩種元素,他把columbium(鈳)命名為niobium(鈮)。
當時,科學家未能有效地把鈳(鈮)和性質極為相似的鉭區分開來。
1809年,英國化學家威廉·海德·沃拉斯頓(William
Hyde Wollaston)對鈳和鉭的氧化物進行比較,
得出兩者的密度分別為5.918g/cm及超過8g/cm。
雖然密度值相差巨大,但他仍認為兩者是完全相同的物質。
另一德國化學家海因裡希·羅澤(Heinrich Rose)在1846年駁斥這一結論,並稱原先的鉭鐵礦樣本中還存在著另外兩種元素。
他以希臘神話中坦塔洛斯的女兒尼俄伯(Niobe,淚水女神)和兒子珀羅普斯(Pelops)
把這兩種元素分別命名為“Niobium”(鈮)和“Pelopium”。
鉭和鈮的差別細微,而因此得出的新“元素”Pelopium、Ilmenium和Dianium實際上都只是鈮或者鈮鉭混合物。
1864年,克利斯蒂安·威廉·布隆斯特蘭(Christian Wilhelm Blomstrand)、
亨利·愛丁·聖克雷爾·德維爾和路易·約瑟夫·特羅斯特(Louis Joseph Troost)
明確證明了鉭和鈮是兩種不同的化學元素,並確定了一些相關化合物的化學公式。
瑞士化學家讓-夏爾·加利薩·德馬里尼亞(Jean Charles
Galissard de Marignac)在1866年進一步證實除鉭和鈮以外別無其他元素。
然而直到1871年還有科學家發表有關Ilmenium的文章。
 1864年,德馬里尼亞在氫氣中對氯化鈮進行還原反應,
1864年,德馬里尼亞在氫氣中對氯化鈮進行還原反應,
首次製成鈮金屬。
雖然他在1866年已能夠製備不含鉭的鈮金屬,
但要直到20世紀初,鈮才開始有商業上的應用:電燈泡燈絲。
鈮很快就被鎢淘汰了,因為鎢的熔點比鈮更高,更適合作燈絲材料。
1920年代,人們發現鈮可以加強鋼材,這成為鈮一直以來的主要用途。
貝爾實驗室的尤金·昆茲勒(Eugene Kunzler)等人發現,
鈮錫在強電場、磁場環境下仍能保持超導性,
這使鈮錫成為第一種能承受高電流和磁場的物質,可用於大功率磁鐵和電動機械。
這一發現促使了20年後多股長電纜的生產。
這種電纜在繞成線圈後可形成大型強電磁鐵,用在旋轉機械、粒子加速器和粒子探測器當中。
純淨的金屬樣本在1864年由Christian Blomstrand制取,他用氫氣加熱還原氯化鈮實現。
 命名
命名
“Columbium”(鈳,符號Cb)是哈契特對新元素所給的最早命名。
這一名稱在美國一直有廣泛的使用,
美國化學學會在1953年出版了最後一篇標題含有“鈳”的論文;
“鈮”則在歐洲通用。
1949年在阿姆斯特丹舉辦的化學聯合會第15屆會議最終決定以“鈮”
作為第41號元素的正式命名。
翌年,國際純粹與應用化學聯合會(IUPAC)也採納了這一命名,
結束了一個世紀來的命名分歧,
儘管“鈳”的使用時間更早。
這可算是一種妥協:IUPAC依北美的用法選擇“Tungsten”而非歐洲所用的“Wolfram”作為鎢的命名,
並在鈮的命名上以歐洲的用法為先。
具權威性的化學學會和政府機構都一般以IUPAC正式命名稱之,
但美國地質調查局以及冶金業、金屬學會等組織至今仍使用舊名“鈳”。
元素性質
鈮是灰白色金屬,熔點2468℃,沸點4742℃,密度8.57克/立方釐米。
室溫下鈮在空氣中穩定,在氧氣中紅熱時也不被完全氧化,高溫下與硫、氮、碳直接化合,能與鈦、鋯、鉿、鎢形成合金。
不與無機酸或堿作用,也不溶于王水,但可溶於氫氟酸。鈮的氧化態為-1、+
2、+3、+4和+5,其中以+5價化合物最穩定。
物理性質
鈮是一種帶光澤的灰色金屬,具有順磁性,屬於元素週期表上的5族。
高純度鈮金屬的延展性較高,但會隨雜質含量的增加而變硬。
它的最外電子層排布和其他的5族元素非常不同。同樣的現象也出現在前後的釕(44)、銠(45)和鈀(46)元素上。
鈮在低溫狀態下會呈現超導體性質。在標準大氣壓力下,它的臨界溫度為9.2K,是所有單質超導體中最高的。
其磁穿透深度也是所有元素中最高的。鈮是三種單質第II類超導體之一,其他兩種分別為釩和鍀。
鈮金屬的純度會大大影響其超導性質。鈮對於熱中子的捕獲截面很低,因此在核工業上有相當的用處。
化學性質
鈮金屬在室溫下長時間存留後,會變為藍色。雖然它在單質狀態下的熔點較高(2,468°C),但其密度卻比其他難熔金屬低。
鈮還能抵禦各種侵蝕,並能形成介電氧化層。鈮的電正性比位於其左邊的鋯元素低。
其原子大小和位於其下方的鉭元素原子幾乎相同,這是鑭系收縮效應所造成的。
這使得鈮的化學性質與鉭非常相近。雖然它的抗腐蝕性沒有鉭這麼高,
但是它價格更低,也更為常見,所以在要求較低的情況下常用以代替鉭,例如作化工廠化學物槽內塗層物料。
化合物
鈮在很多方面都與鉭及鋯十分相似。
它會在室溫下與氟反應,在200°C下與氯和氫反應,以及在400°C下與氮反應,產物一般都是間隙非整比化合物。
鈮金屬在200°C下會在空氣中氧化,且能抵禦熔融堿和各種酸的侵蝕,包括王水、氫氯酸、硫酸、硝酸和磷酸等。
不過氫氟酸以及氫氟酸和硝酸的混合物則可以侵蝕鈮。
雖然鈮可以形成氧化態為+5至−1的各種化合物,但它最常見的還是處於+5氧化態。
氧化態低於+5的鈮化合物中都含有鈮﹣鈮鍵。
氧化物及硫化物
鈮的氧化物可以有以下的氧化態:+5(Nb2O5)、+4(NbO2)和+3(Nb2O3),
另外較罕見的有+2態(NbO)。五氧化二鈮是最常見的鈮氧化物,鈮金屬及所有鈮化合物的製備都需從其開始。
要製成鈮酸鹽,可將五氧化二鈮溶於鹼性氫氧化物溶液中,或熔化於鹼金屬氧化物中。
鈮酸鋰(LiNbO3)具有鈣鈦礦型偏三方晶系結構,而鈮酸鑭則含孤立的NbO3−4離子。
其他已知化合物還包括硫化鈮(NbS2),它會形成層狀結構。
利用化學氣相沉積法或原子層沉積法可以在物料表面加上五氧化二鈮薄層,
兩種方法均用到乙醇鈮(V)在350°C以上會熱分解的原理。
鹵化物
鈮可以形成擁有+5和+4氧化態的鹵化物,以及各種亞化學計量化合物。
五鹵化鈮(NbX5)含有八面體型鈮中心原子。
五氟化鈮(NbF5)是一種白色固體,熔點為79.0°C,而五氯化鈮(NbCl5則呈黃色(見左圖),熔點為203.4°C。
兩者均可經水解形成氧化物和鹵氧化物,例如NbOCl3。
五氯化鈮也是一種具揮發性的試劑,可用于合成包括二氯二茂鈮((C5H5)2NbCl2)在內的各種有機金屬化合物。
鈮的四鹵化物(NbX4)都是深色的聚合物,內含鈮﹣鈮鍵,如呈黑色、
具吸濕性的四氟化鈮(NbF4)和棕色的四氯化鈮(NbCl4)。
鈮的鹵化物負離子也存在,這是因為鈮的五鹵化物都是路易士酸。
最重要的一種為[NbF7],它是鈮和鉭的礦物分離過程中的一個中間化合物。
它比對應的鉭化合物更易轉換為氧五氟化物。其他鹵化配合物還包括[NbCl6]:Nb2Cl10+
2 Cl→ 2 [NbCl6]
鈮還會形成多種還原鹵化物原子簇,如[Nb6Cl18]。
氮化物及碳化物
氮化鈮(NbN)在低溫下會變成超導體,被用在紅外線探測器中。
最主要的碳化鈮是NbC,其硬度極高,是一種耐火的陶瓷材料,可用作切割工具刀頭材料。
鉭和鈮
把它們放到一起來介紹是有道理的,因為它們在元素週期表裡是同族,物理、化學性質很相似,而且常常“形影不離”,
在自然界伴生在一起,真稱得上是一對惟妙惟肖的“孿生兄弟”。
事實上,當人們在十九世紀初首次發現鈮和鉭的時候,還以為它們是同一種元素呢。
以後大約過了四十二年,人們用化學方法第一次把它們分開,這才弄清楚它們原來是兩種不同的金屬。
鈮、鉭和鎢、鉬一樣都是稀有高熔點金屬,它們的性質和用途也有不少相似之處。
既然被稱為稀有高熔點金屬,鈮、鉭最主要的特點當然是耐熱。
它們的熔點分別高達攝氏二千四百多度和將近三千度,不要說一般的火勢燒不化它們,
就是煉鋼爐裡烈焰翻騰的火海也奈何它們不得。
難怪在一些高溫高熱的部門裡,特別是製造一千六百度以上的真空加熱爐,鉭金屬是十分適合的材料。
一種金屬的優良性能往往可以“移植”到另一種金屬裡。
用鈮作合金元素添加到鋼裡,能使鋼的高溫強度增加,加工性能改善。
鈮、鉭與鎢、鉬、釩、鎳、鈷等一系列金屬合作,得到的“熱強合金”,
可以用作超音速噴氣式飛機和火箭、導彈等的結構材料。
科學家們在研製新型的高溫結構材料時,已開始把注意力轉向鈮、鉭;
許多高溫、高強度合金都有這一對孿生兄弟參加。
鈮、鉭本身很頑強,它們的碳化物更有能耐,這個特點與鎢、鉬也毫無二致。
用鈮和鉭的碳化物作基體制成的硬質合金,有很高的強度和抗壓、耐磨、耐蝕本領。
在所有的硬質化合物中,碳化鉭的硬度是最高的。
用碳化鉭硬質合金製成的刀具,能抗得住三千八百度以下的高溫,硬度可以與金剛石匹敵,使用壽命比碳化鎢更長。
應用
人們很早以前就發現,當溫度降低到接近絕對零度的時俟,有些物質的化學性質會發生突然的改變,
變成一種幾乎沒有電阻的“超導體”。
物質開始具有這種奇異的“超導”性能的溫度叫臨界溫度。
不用說,各種物質的臨界溫度是不一樣的。
要知道,超低溫度是很不容易得到的,人們為此而付出了巨大的代價;
越向絕對零度接近,需要付出的代價越大。
所以我們對超導物質的要求,當然是臨界溫度越高越好。
具有超導性能的元素不少,鈮是其中臨界溫度最高的一種。
而用鈮製造的合金,臨界溫度高達絕對溫度十八點五到二十一度,是目前最重要的超導材料。
人們曾經做過這樣一個實驗:把一個冷到超導狀態的金屬鈮環,通上電流然後再斷開電流,
然後,把整套儀器封閉起來,保持低溫。
過了兩年半後,人們把儀器打開,發現鈮環裡的電流仍在流動,而且電流強弱跟剛通電時幾乎完全相同!
從這個實驗可以看出,超導材料幾乎不會損失電流。
如果使用超導電纜輸電,因為它沒有電阻,電流通過時不會有能量損耗,所以輸電效率將大大提高。
有人設計了一種高速磁懸浮列車,它的車輪部位安裝有超導磁體,使整個列車可以浮起在軌道上約十釐米。
這樣一來,列車和軌道之間就不會再有摩擦,減少了前進的阻力。
一列乘載百人的磁懸浮列車,只需一百馬力的推動力,就能使速度達到每小時五百公里以上。
用一條長達二十公里的鈮錫帶,纏繞在直徑為一點五米的輪緣上,繞組能夠產生強烈而穩定的磁場,
足以舉起一百二十二公斤的重物,並使它懸浮在磁場空間裡。
如果把這種磁場用到熱核聚變反應中,把強大的熱核聚變反應控制起來,那就有可能給我們提供大量的幾乎是無窮無盡的廉價電力。
不久前,人們曾用鈮鈦超導材料製成了一台直流發電機。
它的優點很多,比如說體積小,重量輕,成本低,與同樣大小的普通發電機相比,它發的電量要大一百倍。
高溫合金
世界上很大一部份鈮以純金屬態或以高純度鈮鐵和鈮鎳合金的形態,用於生產鎳、鉻和鐵基高溫合金。
這些合金可用於噴射引擎、燃氣渦輪發動機、火箭組件、渦輪增壓器和耐熱燃燒器材。
鈮在高溫合金的晶粒結構中會形成γ''相態。這類合金一般含有最高6.5%的鈮。
Inconel 718合金是其中一種含鈮鎳基合金,各元素含量分別為:
鎳50%、鉻18.6%、鐵18.5%、鈮5%、鉬3.1%、鈦0.9%以及鋁0.4%。
應用包括作為高端機體材料,如曾用於雙子座計畫。
C-103是一種鈮合金,它含有89%的鈮、10%的鉿和1%的鈦,可用於液態火箭推進器噴管,
例如阿波羅登月艙的主引擎。阿波羅服務艙則使用另一種鈮合金。
由於鈮在400°C以上會開始氧化,所以為了防止它變得易碎,須在其表面塗上保護塗層。
鈮基合金
C-103合金是1960年代初由華昌公司和波音公司共同研發的鈮合金。
由於冷戰和太空競賽的緣故,杜邦、美國聯合碳化物、通用電氣等多個美國公司都在同時研發鈮基合金。
鈮和氧容易反應,所以生產過程需在真空或惰性氣體環境下進行,這大大增加了成本和難度。
真空電弧重熔(VAR)和電子束熔煉(EBM)是當時最先進的生產過程,促使了各種鈮合金的發展。
1959年起,研究專案在測試了“C系”(可能取了舊名鈳“Columbium”的首字母)中共256種鈮合金後,
終於制得了C-103。這些合金都可熔化成顆粒狀或片狀。
華昌當時擁有從核級鋯合金提煉而成的鉿元素,並希望發展它的商業應用。
C系中擁有所謂103成份比例的Nb-10Hf-1Ti合金在可模鍛性和高溫屬性之間有著最佳的平衡,
因此華昌于1961年利用VAR和EBM方法生產了首批500磅C-103合金,
應用於渦輪引擎部件和液態金屬換熱器。
同期的其他鈮合金還有:芬斯蒂爾冶金公司的FS85(Nb-10W-28Ta-1Zr)、
華昌和波音的Cb129Y(Nb-10W-10Hf-0.2Y)、聯合碳化物的Cb752(Nb-10W-2.5Zr)及蘇必利爾管道公司的Nb1Zr。
醫療應用
鈮在外科醫療上也佔有重要地位,它不僅可以用來製造醫療器械,而且是很好的“生物適應性材料”。
比如說吧,用鈮片可以彌補頭蓋骨的損傷,鈮絲可以用來縫合神經和肌腱,
鈮條可以代替折斷了的骨頭和關節,鈮絲製成的鈮紗或鈮網,可以用來補償肌肉組織……
在醫院裡,還會有這樣的情況:用鉭條代替人體裡折斷了的骨頭之後,經過一段時間,
肌肉居然會在鈮條上生長起來,就像在真正的骨頭上生長一樣。怪不得人們把鈮叫作“親生物金屬”哩。
為什麼鈮在外科手術中能有這樣奇特的作用呢?
關鍵還是因為它有極好的抗蝕性,不會與人體裡的各種液體物質發生作用,
並且幾乎完全不損傷生物的機體組織,對於任何殺菌方法都能適應,所以可以同有機組織長期結合而無害地留在人體裡。
除了在外科手術中有這樣好的用途外,利用鈮、鉭的僕學穩定性,還可以用它們來製造電解電容器、整流器等等。
特別是鈮,約有一半以上用來生產大容量,小體積,高穩定性的固體電解電容器。全世界每年都要生產幾億隻。
鈮電解電容器沒有“辜負”人們的厚望,它具有很多其他材料比不上的優點。
它比跟它一般大小的其他電容器“兄弟”的電容量大五倍,而且非常可靠、耐震,工作溫度範圍大,使用壽命長,
已經大量地用在電子電腦、雷達、導彈、超音速飛機、自動控制裝置以及彩色電視、立體電視等的電子線路中。
鋼鐵應用
在鋼的各種微合金化元素中,廢鈮是最有效的微合金化元素,鈮的作用如此之大,
以至於鐵原子中含有豐富的鈮原子,就能達到改善鋼性能的目的。
實際上鋼中加入0.001%—0.1%的鈮,就足以改變鋼的力學性能。
例如:當加入0.1%的合金化元素時,提高鋼的屈服強度依次為:
鈮118MPa;釩71.5MPa;鉬40MPa;錳17.6MPa;鈦為零。
實際上鋼中只需加入0.03%—0.05%Nb,鋼的屈服強度便可提高30%以上。
而鋼的成本每噸僅增1美元。
例如:普通中碳鋼的屈服強度一般為250MPa,加入微量鈮可使強度提高到350—800MPa。
鈮作為微合金化元素加入鋼中並不改變鐵的結構,而是與鋼中的碳#氮#硫結合,改變鋼的顯微結構。
鈮對鋼的強化作用主要是的是細晶強化和彌散強化,鈮能和鋼中的碳氮生成穩定的碳化物和碳氮化物。
而且還可以使碳化物分散並形成具有細晶化的鋼。
鈮還可以通過誘導析出和控制冷卻速度,實現析出物彌散分佈。
在較寬的範圍內調整鋼的韌性水準。
因此,加入鈮不僅可以提高鋼的強度,還可以提高鋼的韌性、
抗高溫氧化性和耐蝕性!降低鋼脆性轉變溫度,獲得好的焊接性能和成型性能
該成分被廣泛的應用到連續油管的管材材料中
電瓷
鈮酸鋰是一種電鐵性物質,在手提電話和光調變器中以及表面聲波設備的製造上有廣泛的應用。
它的晶體結構屬於ABO3型,與鉭酸鋰和鈦酸鋇相同。鈮可以代替鉭電容器中的鉭,降低成本,但鉭電容器仍較為優勝。
錢幣
在錢幣上,鈮有時會與金和銀一起用在紀念幣上作貴重金屬。
例如,奧地利自2003年起,生產了一系列銀鈮歐羅幣,其顏色是陽極化過程形成的氧化物表層衍射所產生的。
2012年,共有十種中心顏色不同的錢幣,共包括藍、綠、棕、紫和黃。
另外含有鈮的錢幣還有2004年的奧地利賽梅林鐵路150周年紀念幣,以及2006年歐洲衛星導航紀念幣。
2011年,加拿大皇家造幣廠開始鑄造稱為“狩獵月”(Hunter's
Moon)的5加元純銀和鈮幣。
其中的鈮經過特殊的氧化過程,所以沒有兩件成品是完全一樣的。
其他
鈮(或摻有1%鋯)是高壓鈉燈電弧管的密封材料,因為鈮的熱膨脹係數與經燒結的礬土弧光燈陶瓷材料非常相近。
這種用於鈉燈的陶瓷可以抵禦化學侵蝕,也不會與燈內的高溫鈉液體和氣體產生還原反應。
鈮也被用在電弧焊條上,用來焊接某些穩定化不銹鋼。
一些大型水箱的陰極保護系統中以鈮作為陽極的材料,陽極一般再鍍上一層鉑。