 金屬銫是一種金黃色,熔點低的活潑金屬,
金屬銫是一種金黃色,熔點低的活潑金屬,
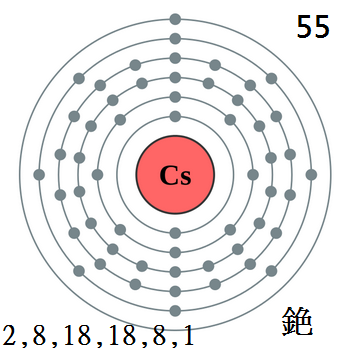
銫
 金屬銫是一種金黃色,熔點低的活潑金屬,
金屬銫是一種金黃色,熔點低的活潑金屬,
在空氣中極易被氧化,能與水劇烈反應生成氫氣且爆炸。
銫在自然界沒有單質形態,
銫元素以鹽的形式極少的分佈于陸地和海洋中。
銫也是製造真空件器、光電管等的重要材料。
放射性核素Cs-137是日本福島第一核電站洩露出的放射性污染中的一種。
發現簡史
銫最終被基爾
他們檢測了來自Durkheim的礦物質水,
並且在光譜中觀察到了他們不能認出的線,這意味著一個新的元素的出現。
他們從這個來源生產出了約
第一個成功制出金屬銫的這個榮譽歸屬于波恩大學的考爾· 希歐多爾·賽特伯格(Carl Theodor Setterberg)教授,
他由電解熔融的氰化銫(CsCN)獲取了它。
命名是由其發現者基爾
礦藏分佈
銫在地殼中含量為3.2×10-4%(百萬分之三點二),銫榴石是含銫礦物,也是提取銫的主要原料。
已發現34種銫的同位素,除銫–133是唯一存在於自然界的穩定同位素;其餘皆是鈾裂變產生的放射性同位素。
Durkheim的礦物質水中含有豐富的銫化合物,所以可以從Durkheim的礦物質水提取。
銫元素一般分佈在含礦物質較多的水中。
物理性質
銫位於第六週期的鹼金屬(IA)族,是帶金黃色的銀白色鹼金屬,非常柔軟(它的莫氏硬度是所有元素中最低的),具有延展性。
金屬銫是沒有放射性的,但是金屬銫屬於危險化學品,屬遇濕易燃和自燃物品。使用時應小心。
天然存在的銫133是一種穩定同位素,而其他銫同位素則屬於放射性。
化學性質
銫的生物行為與鉀相似,食用了含銫–137的生物可溶化合物24小時後,
銫–137可被人體充分吸收並結合在細胞內,造成內照射。
銫-137可作為γ輻射源,用於輻射育種、輻照儲存食品、醫療器械的殺菌、癌症的治療以及工業設備的γ探傷等。
由於銫源的半衰期較長及其易造成擴散的弱點,故銫-137源已漸被鈷-60源所取代。
溶膠取樣中還檢測到了極微量的人工放射性核素銫-137和銫-134,其濃度均在10-5貝克/立方米量級及以下。
環境中銫-137進入人體後易被吸收,均勻分佈於全身;由於銫-137能釋放γ射線,很容易在體外測出。
進入體內的放射性銫主要滯留在全身軟組織中,尤其是肌肉中,在骨和脂肪中濃度較低;
較大量放射性銫攝入體內後可引起急、慢性損傷。
中毒
銫的化學性質極為活潑,銫在空氣中生成一層灰藍色的氧化銫,不到一分鐘就可以自燃起來,
發出深紫紅色的火焰,生成很複雜的銫的氧化物。理論上,銫在鹼金屬中活潑性僅次於鈁,
但由於目前尚未制得純鈁,所以我們可以認為銫在鹼金屬中是最活潑的,能和氧發生劇烈反應,生成多種銫氧化物。
在潮濕空氣中,氧化的熱量足以使銫熔化並燃燒。銫不與氮反應,但在高溫下能與氫化合,生成相當穩定的氫化物。
銫與水反應 劇烈爆炸
銫能與水發生劇烈的反應,如果把銫放進盛有水的水槽中,馬上就會發生爆炸。
甚至和溫度低到
生成的氫氧化銫是無放射性的氫氧化堿中鹼性最強的。
與鹵素也可生成穩定的鹵化物,這是由於它的離子半徑大所帶來的特點。
銫和有機物也會發生同其他鹼金屬相類似的反應,但它比較活潑。
 銫鹽跟鉀鹽、鈉鹽一樣溶於所有鹽溶液中
銫鹽跟鉀鹽、鈉鹽一樣溶於所有鹽溶液中
(鈉鹽不溶於醋酸鈾醯鋅鈉、三鈦酸鈉、鉍酸鈉等極少數鈉鹽)。
但是高氯酸鹽不溶。
碘化銫與三碘化鉍反應能生成難溶的亮紅色複鹽,
此反應用來定性和定量測定銫;
銫的火焰呈比鉀深的紫紅色,可用來檢驗銫。
化合物:
銫在空氣中氧化不僅僅得到氧化銫、
過氧化銫,還有超氧化銫、臭氧化銫等複雜的非整比化合物產生。
Cs的鹽通常是無色的,除非陰離子有顏色(如高錳酸銫是紫色的)。
許多簡單的鹽具有潮解性,但比更輕的其他鹼金屬弱。
銫的乙酸鹽、碳酸鹽、鹵化物、氧化物、
硝酸鹽和硫酸鹽可溶于水。
複鹽通常溶解度較小,硫酸鋁銫溶解度較小的性質常用來從礦石中提純銫。
與銻(例如CsSbCl4)、鉍、鎘、銅、鐵和鉛形成的複鹽通常溶解度很小。
氫氧化銫(CsOH)是一種具有強烈吸水性的強鹼。它能迅速腐蝕半導體材料(例如矽)的表面。
過去化學家曾認為CsOH是“最強的堿”,但是許多化合物的鹼性遠比CsOH強,例如正丁基鋰和氨基鈉。

製備方法
銫可以用電解法和熱還原法製備。但是由於對電極有強腐蝕性,工業上一般不用電解法。
所以工業上是由氯化銫高溫用金屬鈣還原制取金屬銫。
銫榴石是含銫量很高的礦石,它的生產主要分成簡單的採礦,粉碎到需要的75μm粒度,
在某些情況下進行手選,不需要其他富集。雖然在美國和俄羅斯已經發展有浮選過程用於低品位礦的富集。
所得的精礦要進行提取銣和銫原料的前期處理,
採用工藝有3種:礦石的直接還原法、氯化焙燒法和酸分解法。
無論哪種方法,都要將銣和銫浸取入溶液中,再經過濃縮和分離。
銫榴石在燒結前,與石灰及氯化鈣混合,其比例:20%礦物,66%石灰和4%
CaC12。
在800∼
然後將得到的燒結物溶浸,過濾後加硫酸蒸發以完全除去鹽酸。
分離出沉澱後,再加SbC13溶液反應形成白色的銫銻鹽結晶粉末。
溶解結晶後,再用H2S除去硫化銻,得到CsCl溶液。
有報導將礦石先進行氯化焙燒,經浸取和萃取成功地提取了RbCl,提取率78%∼93%。
一、堿分解法
將銫榴石礦石堿解採用兩種配料,即(1)礦石與CaCO3-CaCl2混合在800∼
(2)礦石與Na
即Cs2SO4·Al2(SO4)3·24H2O,銫完全可以從銫榴石礦中提取出來。
有報導用煤油與酚萃取CSCl溶液的方法。
二、酸法浸取
用酸浸取銫榴石是生產商品銫鹽的第一個過程,通常用的無機酸有HF,HBr,HCI和H2SO4,
在法國使用的是HF,它能使銫完全回收,然而,使用HF的困難卻能抵消它的益處。
同樣,可用HBr將銫榴石轉變成溴化物,用異丙醇沉澱溴化銫,用液態Br2將銫轉移出來。
該法未被使用的原因是由於用熱酸帶來的工程問題。一般說來採用鹽酸浸溶和硫酸浸溶較多。
(一)HCl浸溶法
酸分解法中以鹽酸法應用最普遍(見圖1),用濃鹽酸分解銫榴石,浸出率可以達到97%。
將磨細的銫榴石精礦和濃鹽酸,放在帶有回流冷凝器的耐酸槽中,於沸騰溫度下不斷攪拌進行礦石分解。
過濾分離含矽的殘渣。
不純的CsCl能夠用生成複鹽,如
複鹽終重結晶純化採用水解或用H2S沉澱得到純CsCl。
另外,也能夠使用溶劑萃取辦法直接從HC1浸取液中直接萃取CsCl。
(二)
H2SO4浸溶法
硫酸對銫榴石浸漬的方法(見圖2)已經由幾個實驗室進行過研究,
包括加拿大渥太華的Canadian Mines公司分部,
採用銫榴石在接近於35%∼40%
H2SU4的沸點溫度
接著趁熱真空過濾,浸取液分段冷卻到
加碳粉進行焙燒反應如:Cs2SO4·A12(SO4)3·24H2O+O2+C→24H2O+Cs2SO4+SO2+
分離殘渣,得到Cs2SO4溶液,採用Dowex50陽離子樹脂進行交換,用10%
HCl淋洗的辦法轉變成CsCl。
使用NH3·H2O或石灰進行處理,使Al沉澱。或者採用溶荊萃取,接著在中性pH採用H2O或進行NH3純化。
由Carus公司開發的一個加工過程,是使用伊里諾州的銫榴石,
採用H2SO4進行浸取,並形成銫礬鹽,幾種鹼金屬礬鹽在不同溫度時的溶解度曲線如圖3所示,
根據溶解度的不同可以分級沉澱分離K、Rb和Cs。
將Cs礬鹽溶於NsOH溶液中形成氫氧化銫礬和K2SO4。
鐵、鋁氫氧化物沉澱析出,過濾除去,再加人KMnO4直接使銫沉澱為CsMnO4。
CaAl(SO4)2·12H2O+KOH
→CeAl(OH)4+2K2SO4+12H2O
CsAl(OH)4+KMnO4→CsMnO4(s)+KAl(OH)4
離心過濾得到純的CsMnO4。再採用如甲醇這樣的試劑使之還原後轉變成碳酸鹽或氯化物。
德國Chemical公司是世界上主要加工廠;Cabot公司是美國唯一的一家生產廠。
其他是較小的生產廠,包括日本的公司Daiichi Kigenso和美國的BDH公司。俄羅斯利用進口的銫榴石進行生產。
應用領域
 裂變產物
裂變產物
長壽命的銫–137是鈾-235的裂變產物。
半衰期30.17年,可輻射β射線和γ射線,用作β和γ輻射源,用於工農業和醫療。
隨著核燃料放射性廢物儲放的時間,其輻射的γ射線比例增加;是儲存的主要物件。
離子火箭
為了探索宇宙,必須有一種嶄新的、飛行速度極快的交通工具。
一般的火箭、飛船都達不到這樣的速度,最多只能沖出地月系;
只有每小時能飛行十幾萬公里的“離子火箭”才能滿足要求。
銫原子的最外層電子極不穩定,
很容易被激發放射出來,變成為帶正電的銫離子,
所以是宇宙航行離子火箭發動機理想的“燃料”。
銫離子火箭的工作原理是這樣的:發動機開動後,產生大量的銫蒸氣,銫蒸氣經過離化器的“加工”,
變成了帶正電的銫離子,接著在磁場的作用下加速到每秒
同時給離子火箭以強大的推動力,把火箭高度推向前進。
計算表明,用這種銫離子作宇宙火箭的推進劑,單位重量產生的推力要比使用的液體或固體燃料高出上百倍。
這種銫離子火箭可以在宇宙太空遨遊一二年甚至更久!
 原子鐘
原子鐘
銫原子的最外層的電子繞著原子核旋轉的速度,
總是極其精確地在幾十億分之一秒的時間內轉完一圈,
穩定性比地球繞軸自轉高得多。
利用銫原子的這個特點,
人們製成了一種新型的鐘——銫原子鐘。
規定一秒是銫-133原子基態的超精細能級之間的躍遷
所對應的輻射的9192631770個週期所持續的時間。
這就是“秒”的最新定義。
利用銫原子鐘,人們可以十分精確地測量出十億分之一秒的時間,
精確度和穩定性遠遠地超過世界上以前有過的任何一種表,
也超過了許多年來一直以地球自轉作基準的天文時間。
有了像銫原子鐘這樣一類的鐘錶,
人類就有可能從事更為精細的科學研究和生產實踐,
比如對原子彈和氫彈的爆炸、火箭和導彈的發射以及宇宙航行等等,實行高度精確的控制,當然也可以用於遠端飛行和航海。
用銫作成的原子鐘,可以精確的測出十億分之一秒的一刹那,它連續走上三十萬年,誤差也不超過1s,精確度相當高.,
另外,銫在醫學上、導彈上、太空船上及各種高科技行業中都有廣泛應用。