強酸
強酸,是指在水溶液中接近完全電離的酸(硫酸這類多元酸不在此限),
或以酸度係數的概念理解,則指pKa值 < −1.74的酸。
這個值可以理解為在標準狀況下,氫離子的濃度等同於加入強酸後的溶液濃度。
大部分強酸均是腐蝕性的,但當中亦有例外。
例如超強酸當中的碳硼烷酸(H(CHB
相反,弱酸當中的氫氟酸(HF)卻是高度腐蝕性,而且能溶解極大部分的金屬氧化物,
諸如玻璃及除了銥以外的所有金屬。

強酸在水溶液中完全離解的化學方程式如下所示:HA(aq)
→ H+(aq) + A−(aq)
一般酸不會在水中完全離解,因此多以化學平衡而不是完全反應的形式表示,弱酸就是指不完全離解的酸。
用酸度係數作為區別強酸與弱酸的作用並不明顯(因為數值差距較難理解及不明顯),因此用方程式去區別兩者更為合理。
由於強酸在水溶液中可被近似認為完全離解,
因此氫離子在水中的濃度可被認為等同於將該酸帶到其他的溶液當中:[HA]
= [H+] = [A−];pH
= −log[H+]
酸性強度的判別
除了透過計算pH值來衡量不同酸的強度外,
透過觀察以下的性質也可以判別出不同類別的酸的強度:
電負性:在同一元素周期下其共軛鹼的負電性愈高,它的酸度就愈高。
原子半徑:原子半徑增加,其酸度也會增加。
以氫氯酸及氫碘酸為例,兩者均是強酸,在水中均會電離出100%的相應離子。
但是氫碘酸的酸度比氫氯酸要強,這是因為碘的原子半徑遠大於氯的原子半徑。
帶有負電荷的碘陰離子擁有較離散的電子雲,因此與質子(H+)的吸力較弱,
因此,氫碘酸電離(去質子化)的速度更快。
電荷:電離後的物質愈帶有正電荷,就愈高酸度。
因此中性分子較陰離子容易放出質子,陽離子也比起其他分子均具有更高酸度。
強酸
常見的強酸──硫酸的立體模型
常見強酸
高氯酸HClO4
>氫碘酸HI
>氫溴酸HBr
氫氯酸HCl
水合氫離子H3O+或H+。為方便起見,通常會以H+取代H3O+。
但要注意的是,單獨而孤立的質子在帶有極性的水中不可能存在,而是常與水分子的其中一對孤偶電子對結合。
一些化學家將氯酸(HClO3),溴酸(HBrO3),過溴酸(HBrO4),碘酸(HIO3),和過碘酸(HIO4)也列為強酸,但是沒有被公認。
超強酸
(從最強到最弱)
氟銻酸HFSbF5
>魔酸FSO3HSbF5
>碳硼烷酸H(CHB
超強酸是指比純硫酸酸性更強的酸。
簡單的超強酸包括三氟甲磺酸和氟磺酸,它們的酸性都是硫酸的上千倍。
在更多的情況下,超強酸不是單一純淨物而是幾種化合物的混合物,如王水。
超強酸這一術語由詹姆斯·布萊恩特·科南特於1927年提出,用於表示比通常的無機酸更強的酸。
喬治·安德魯·歐拉因其在碳正離子和超強酸方面的研究獲得1994年諾貝爾化學獎。
超強酸的例子
氟銻酸
氟銻酸(Fluoroantimonic
acid),是氟化氫(HF)與五氟化銻(SbF5)的混合物,為現在已知最強的超強酸。
其中,氟化氫提供質子(H+)和共軛鹼氟離子(F−),
氟離子通過強配位鍵與親氟的五氟化銻生成具有八面體穩定結構的六氟化銻陰離子(SbF6−),
而該離子是一種非常弱的親核試劑和非常弱的鹼。
於是質子就成為了「自由質子」,從而導致整合體系具有極強的酸性。
氟銻酸的酸性通常是純硫酸的2×1019倍(哈米特酸度函數
= − 31.3)。
氫氟酸和五氟化銻按1
:0.3(摩爾比)混合時,它的酸性是濃硫酸的1億倍;按1
:1混合時,
它的酸性是濃硫酸的10億倍;按0.2 :1混合時,其酸性是100%純硫酸的109倍。
所以王水在它們面前只能是「小巫見大巫」。
由於超強酸的酸性和腐蝕性強的出奇,所以過去一些極難或根本無法實現的化學反應,在超強酸的條件下便能順利進行。
比如正丁烷,在超強酸的作用下,可以發生碳氫鍵的斷裂,生成氫氣,也可以發生碳碳鍵的斷裂,生成甲烷,
還可以發生異構化生成異丁烷,這些都是普通酸做不到的。
魔酸
魔酸(Magic acid)是最早發現的超強酸,稱它有魔法是因為它能夠分解蠟燭中的蠟。
魔酸是一種路易斯酸五氟化銻(SbF5)和一種質子酸氟磺酸(FSO3H)的混合物。(哈米特酸度函數
= − 19.2)
碳硼烷酸
碳硼烷酸(Carborane superacid):2004年,
河濱加州大學的Christopher
Reed研究小組合成出了這種最強的純酸—碳硼烷酸(化學式:CHB
碳硼烷的結構十分穩定且體積較大,一價負電荷被分散在碳硼烷陰離子的表面,
因而與氫陽離子的作用很弱,從而具有令人吃驚的釋放氫離子的能力。
酸性是氟硫酸的一千倍,純硫酸的一百萬倍,但由於碳硼烷的結構穩定,
在釋出氫離子後難以再發生變化,因此腐蝕性極低,又被稱為最溫和的超強酸。(哈米特酸度函數
= − 18.0)
氫氟酸
氫氟酸是氟化氫的水溶液,具有強烈的腐蝕性,純氟化氫有時也稱作無水氫氟酸。
因為氫原子和氟原子間結合的能力相對較強,使得氫氟酸在水中不能完全電離,
所以理論上低濃度的氫氟酸是一種弱酸,但是氫氟酸卻能夠溶解很多其他酸都不能溶解的玻璃(二氧化矽)。
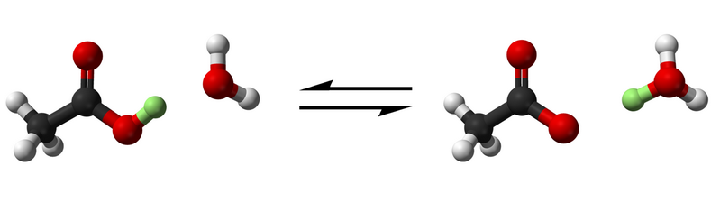
反應方程式如下:![]()
以上反應分兩步進行:![]()
SiF4易溶於水,與HF繼續反應:![]()
正因如此,它必須儲存在塑料容器中(放在聚四氟乙烯容器中最好)。
如果要長期儲存,不僅需要密封容器,而且容器應儘可能真空,因為氫氟酸能夠溶解絕大多數無機氧化物。
高濃度的氫氟酸是強酸,
原因是發生了如下反應:![]()
生產
實驗室中用螢石(氟化鈣
CaF2)和濃硫酸來製造氫氟酸。
加熱到
反應方程式為:![]()
這個反應生成的蒸氣是氟化氫、硫酸和其他幾種副產品的混合物。
在此之後氟化氫可以通過蒸餾來提純。工業上的氫氟酸是通過用酸分解磷灰石獲得的。
汽車發動機產生的氣體中也有氟化氫。這是某些種類橡膠做的皮圈和軟管在
用途
由於氫氟酸溶解氧化物的能力,它在鋁和鈾的提純中起著重要作用。
氫氟酸也用來蝕刻玻璃,半導體工業使用它來除去矽表面的氧化物,
在煉油廠中它可以用作異丁烷和丁烷的烷基化反應的催化劑,
除去不鏽鋼表面的含氧雜質的「浸酸」過程中也會用到氫氟酸。
氫氟酸也用於多種含氟有機物的合成,比如特氟隆(聚四氟乙烯),還有氟利昂一類的致冷劑。
安全性
在人體內部,氫氟酸與鈣離子和鎂離子反應,正因為如此,它會使依靠以上兩種離子發揮機能的器官喪失作用。
接觸、暴露在氫氟酸中一開始可能並不會疼痛,而徵狀可能直到幾小時後氫氟酸與骨骼中的鈣反應時才會出現。
如果不進行處理,最終可能導致心、肝、腎和神經系統的嚴重甚至是致命損傷。
接觸氫氟酸後的初始救護措施通常包括在接觸部位塗上葡萄糖酸鈣凝膠。
如果接觸範圍過廣,又或者延誤時間太長的話,醫護人員可能會在動脈或周圍組織中注射鈣鹽溶液。
但無論如何,接觸氫氟酸後必須得到及時並且專業的護理。
即使能得到及時治療,身體表面少於10%的面積暴露在氫氟酸中也會是致命的。
(身體少於2%的面積暴露在氫氟酸中也有可能是致命的。)
吞服高濃度的氫氟酸溶液會導致急性的低血鈣症,引致心臟停搏及死亡。
http://zh.wikipedia.org/wiki/%E6%B0%A2%E6%B0%9F%E9%85%B8
……………………………………………..............................................................................................................
鹼
在各種酸鹼理論中,鹼都是指與酸相對的一類物質。鹼多指鹼金屬及鹼土金屬的氫氧化物,
而對鹼最常見的定義是根據阿倫尼烏斯(Arrhenius)提出的酸鹼離子理論作出的定義:
鹼是一種在水溶液中可以電離出氫氧根離子並且不產生其它陰離子的化合物。
隨後這個定義被擴展為提供氫氧根或者吸收氫離子的化合物。
根據不同的酸鹼理論,鹼有著不同的定義。
溶液的鹼性
在阿倫尼烏斯酸鹼離子理論中,鹼都是可溶於水的,並且它們的水溶液的pH值都大於7。
鹼在溶液里提供氫氧根或者吸收氫離子,造成溶液中的OH−比H+多,
而常溫下純水的pH值為7——即中性時OH−的濃度為10−

如
按上式完全電離,氫氧根濃度也是
一些非氫氧化物可以在水中水解,
產生氫氧根而顯鹼性:Na
但只要是能在水中產生氫氧根的物質,就都能與酸(尤其是強酸)發生中和反應。
以NaOH和HCl的反應為例:NaOH
→ Na+ + OH−
HCl
→ H+ + Cl−
然後生成水:H+ + OH−
→ H2O
與Na
鹼的定義
在酸鹼質子理論(Brønsted-Lowry理論)中,鹼是能接受質子(氫離子)的物質,
鹼與質子結合後形成的物質叫做鹼的共軛酸。例如在以下的反應中,水扮演鹼的角色,
其共軛酸為 H3O+。
CH3COOH + H2O
→ H3O+ +
CH3COO−
酸鹼質子理論可以延伸到非水溶液的情形。
在酸鹼電子理論(Lewis理論)中,鹼是能給出孤對電子的物質,
對於一切有空軌道的物質,鹼都可與之進行加合反應。這個定義的範圍是最廣的。
酸鹼電子理論的鹼又稱為路易士鹼,如以下的例子中,氯離子提供孤對電子對,即為路易士鹼。
AlCl3 + Cl−
→ AlCl4−
鹼的性質
使酸鹼指示劑變色:
使紅色石蕊試液變藍,無色酚酞變紅和酸發生中和反應:鹼
+
酸
→
鹽 +
水
和鹽發生複分解反應:鹼(可溶)
+
鹽(可溶)
→
新鹼 +
新鹽:2NaOH +
CuSO4
→ Cu(OH)2↓
+ Na2SO4
和某些非金屬氧化物反應:鹼(可溶)
+
某些非金屬氧化物
→
水 +
鹽
通常有滑膩感、味道苦,而且是腐蝕性。因此多用作清潔用途,腐蝕和去除污垢
常見的鹼
氫氧化鈉[NaOH] -
又叫燒鹼、火鹼、苛性鈉
氫氧化鈣[Ca(OH)2] -
俗稱熟石灰、消石灰
氨水NH3·H2O
鹼味
鹼在人類口感中,往往呈現生澀的味覺感受,類似未成熟的柿子、香蕉的單寧口感。
同酸味相對,只是與酸不同的是,一般鹼在普通人印象中沒有如同酸一樣的可讓人聞到的氣味。
超強鹼
超強鹼就是鹼性極強的物質。
目前對超強鹼尚沒有明確的定義,但一些化學家以氫氧化鈉作為強鹼和超強鹼的界限。
另一個強鹼和超強鹼的界限是氫氧根離子,因為氫氧根是在水溶液中鹼性最強的物質,
更強的鹼在水中會和水產生中和反應,產生氫氧根及質子化的鹼。
另一個定義超強鹼的方式是利用是否可使羰基失去
α
氫變成烯醇來判別,一般的鹼無法產生上述的反應。
不過超強鹼一詞目前還沒有一個標準的化學定義,例如質子海綿也會稱為超強鹼。
超強鹼在1950年代開始研究,在有機合成中很重要,也是物理有機化學的基礎。
有用到超強鹼的反應需特別的處理,因為反應會被水及空氣中的二氧化碳和氧氣所破壞,
惰性氣體及低溫可以減少其副作用,超強鹼也是腐蝕性物質。
定義
IUPAC對超強鹼的定義是「有高鹼性的化合物,例如二異丙基氨基鋰」。
Caubère對於超強鹼有量化,而更準確的定義:
「『超強鹼』一詞應該只能用來表示由二種(或多種)鹼混合而成的鹼,而且所生成的鹼需要有原來的鹼沒有的新性質。
『超強鹼』一詞不應該只是指一些在熱力學上或反應動力學上比其他鹼要強的鹼」
超強鹼也有半量化的定義,其定義為絕對質子親合能(APA = 245.3 kcal/mol)
及固有氣體相鹼度(GB =
239 kcal/mol)都比羅傑·阿爾德提出的質子海綿(1,8-雙
分類
超強鹼主要可分為三種:有機化合物、有機金屬化合物及無機化合物。
有機化合物
有機的超強鹼幾乎都是含氮的化合物。
很多有機超強鹼在有機合成中越來越重要,包括磷腈、脒類及胍類等。
此外也有一些有機化合物符合物理化學或是結構上對於超強鹼的定義,
像芳香系的質子海綿及雙哌啶醯胺(bispidine)等質子螯合劑也是超強鹼。
像DABCO之類的多環多胺也可能可以視為是一種超強鹼。
有機金屬化合物
活性較強的金屬產生的有機金屬化合物多半是超強鹼,如有機鋰化合物及有機鎂化合物(格林尼亞試劑)。
另一種超強鹼的來源是活性較強的金屬取代了連接非碳原子上的氫,
非碳原子包括氧(不飽和的醇鹽)或是氮(例如二異丙基氨基鋰)。
有機合成中常用到的超強鹼是施洛瑟鹼(Schlosser's base)。
因為鋰和醇基中氧的親和力,正丁基鋰和叔丁醇鉀交換陽離子成為正丁基鉀及叔丁醇鋰,
而正丁基鋰的鋰被鉀置換後,使得正丁基的離子性變強,因此整體的鹼性也隨之增加。
其特性也和叔丁醇鉀截然不同。
無機化合物
無機的超強鹼一般來說是鹽類,解離後產生高價數,體積小的陰離子。
如氮化鋰的陰離子負電荷密度高,因此容易吸引其他的酸,例如水合氫離子。
鹼金族及鹼土金族的氫化物(如氫化鈉、氫化鈣)也是超強鹼。
有超強鹼參與的反應通常對水敏感,需在低溫的條件下,在不易反應的氣體中進行。
許多反應都希望在不易產生親核反應的條件下進行,也就是以非親核鹼的身份參與反應。
如無障礙的烷基鋰不能和像是帶羰基的親電試劑一起使用,因為烷基鋰會以親核試劑的身份和親電試劑反應。
參考資料:維基百科
http://zh.wikipedia.org/wiki/%E5%BC%BA%E9%85%B8
http://zh.wikipedia.org/wiki/%E8%B6%85%E5%BC%BA%E9%85%B8