
蛋白質
蛋白質是一種由胺基酸分子組成的有機化合物,舊稱「朊」。
胺基酸分子呈線性排列,相鄰胺基酸殘基的羧基和氨基通過肽鍵連接在一起。
蛋白質的胺基酸序列是由對應基因所編碼。
除了遺傳密碼所編碼的20種「標準」胺基酸,在蛋白質中,
某些胺基酸殘基還可以被翻譯後修飾而發生化學結構的變化,從而對蛋白質進行激活或調控。
多個蛋白質可以一起,往往是通過結合在一起形成穩定的蛋白質複合物,發揮某一特定功能。
與其他生物大分子(如多糖和核酸)一樣,蛋白質是地球上生物體中的必要組成成分,
參與了細胞生命活動的每一個進程。
酶是最常見的一類蛋白質,它們催化生物化學反應,尤其對於生物體的代謝至關重要。
除了酶之外,還有許多結構性或機械性蛋白質,如肌肉中的肌動蛋白和肌球蛋白,
以及細胞骨架中的微管蛋白
(參與形成細胞內的支撐網路以維持細胞外形)。
另外一些蛋白質則參與細胞信號傳導、免疫反應、細胞黏附和細胞周期調控等。
同時,蛋白質也是人們日常飲食中必需的營養物質,這是因為動物自身無法合成所有必需胺基酸;
通過消化所攝入的蛋白質食物(將蛋白質降解為胺基酸),
人體就可以將吸收的胺基酸用於自身的蛋白質合成。
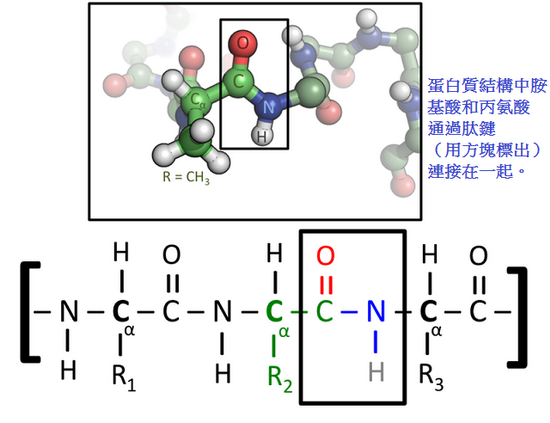

胺基酸和肽
蛋白質是由不同的L型α胺基酸所形成的線性聚合物。
目前在絕大多數已鑒定的天然蛋白質中發現的胺基酸有20種(參見標準蛋白胺基酸列表)。
不過在自然界中還存在著一些特殊的胺基酸,例如在一種海洋寡毛綱小蠕蟲Olavius algarvensis以及與之存在共生關係的細菌δ1
(該細菌屬於δ變形菌)中存在著高含量的硒代半胱氨酸,由原本為終止密碼子的UGA編碼,和吡咯賴胺酸,由終止密碼子UAG編碼。
所有胺基酸都有共同的結構特徵,包括與氨基連接的α碳原子,一個羧基和連接在α碳原子上的不同的側鏈。
但脯氨酸有著與這種基本結構不同之處:
它含有一個側鏈與氨基連接在一起所形成的特殊的環狀結構,使得其氨基在肽鍵中的構象相對固定。
標準胺基酸的側鏈是構成蛋白質結構的重要元素,它們具有不同的化學性質,因此對於蛋白質的功能至關重要。
多肽鏈中的胺基酸之間是通過脫水反應所形成的肽鍵來互相連接;
一旦形成肽鍵成為蛋白質的一部分,胺基酸就被稱為「殘基」,而連接在鏈的碳、氮、氧原子被稱為「主鏈」或「蛋白質骨架」。
由於肽鍵有兩種共振態,具有一定的雙鍵特性,使得相鄰α碳之間形成肽平面;而肽鍵兩側的二面角確定了蛋白質骨架的局部形態。
由於胺基酸的非對稱性(兩端分別具有氨基和羧基),蛋白質鏈具有方向性。
蛋白質鏈的起始端有自由的氨基,被稱為N端或氨基端;尾端則有自由的羧基,被稱為C端或羧基端。
「蛋白質」、「多肽」和「肽」這些名詞的含義在一定程度上有重疊,經常容易混淆。
「蛋白質」通常指具有完整生物學功能並有穩定結構的分子;
而「肽」則通常指一段較短的胺基酸寡聚體,常常沒有穩定的三維結構。
然而,「蛋白質」和「肽」之間的界限很模糊,通常以20-30個殘基為界。
「多肽」可以指任何長度的胺基酸線性單鏈分子,但常常表示缺少穩定的三級結構。
蛋白質生物合成
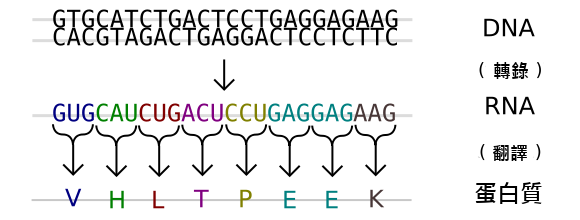
每一種蛋白質都有自己獨特的胺基酸序列,而胺基酸序列的組成信息則由編碼對應蛋白質的基因的核苷酸序列所決定。
遺傳密碼是一套由三個核苷酸組成的密碼子,每一種三個核苷酸的組合可以編碼一種特定胺基酸,
如mRNA上的AUG(在DNA中為ATG)編碼甲硫氨酸。
由於DNA含有四種核苷酸(A、T、C、G),所以對應的可能的密碼子有4×4×4=64種;
而標準胺基酸只有20種,因此有部分密碼子是冗餘的,即部分胺基酸可以由多個不同的密碼子所編碼。
DNA中的基因首先在RNA聚合酶等蛋白質的作用下被轉錄為前mRNA。
在大多數生物體中,前mRNA(或初始轉錄產物)要經過轉錄後修飾以形成成熟的mRNA,
隨後mRNA就可以經由核糖體被用作蛋白質合成的模板。
在原核生物中,mRNA可能可以在生成後被直接用於蛋白質合成,或者在離開類核後就結合核糖體。
而在真核生物中,mRNA在細胞核中被合成,然後通過核膜被轉運到細胞質中;
在細胞質中,mRNA才可以被用於蛋白質合成。原核生物的蛋白質合成速率可以達到每秒20個胺基酸,要高於真核生物。
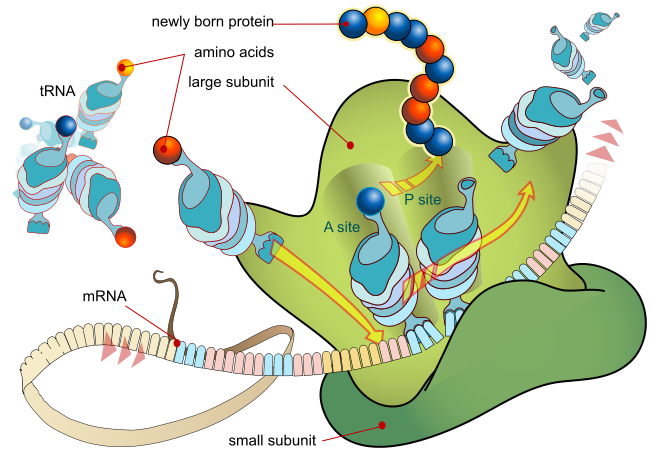
從一個mRNA模板合成一個蛋白質的過程被稱為翻譯。
在翻譯過程中,mRNA被一些蛋白質攜帶到核糖體上;
然後核糖體在mRNA上從5'端到3'端
尋找起始密碼子(大多數情況下為AUG);
找到起始密碼子後,
即核糖體上起始tRNA的反密碼子與起始密碼子配對後,
翻譯就可以開始進行;
在起始密碼子後,
核糖體每一次閱讀三個核苷酸(或一個密碼子),同樣是通過攜帶對應胺基酸的tRNA上反密碼子與密碼子配對。
其中,氨醯tRNA合成酶可以將tRNA分子與正確的胺基酸連接到一起。
不斷延長的多肽鏈通常被稱為「新生鏈」。生物體中的蛋白質合成總是從N-端到C-端。
合成的蛋白質的大小可以通過其含有的胺基酸數目或者其分子量(以道爾頓或千道爾頓,即kDa為單位)來衡量。
酵母蛋白的平均長度為466個胺基酸或平均分子量為53kDa。
目前已知的最大蛋白質是肌聯蛋白,它是肌肉中肌節的組分之一,其分子量為近3,000
kDa,含有近27,000個胺基酸。
化學合成
除了生物合成外,一些小的蛋白質可以通過多種化學途徑來合成,這些合成方法又被稱為肽合成,
其依賴於有機合成技術,如化學連接來高通量生產肽。
化學合成允許在合成的肽鏈中引入非天然胺基酸,如加入螢光標記的胺基酸。
這些合成方法所合成的產物被大量應用於生物化學和細胞生物學實驗。
但是,化學合成無法有效合成殘基數多於300的蛋白質,而且合成的蛋白質可能不具有天然的三級結構。
大多數化學合成方法都是從C-端到N-端進行合成,剛好和生物合成反應的方向相反。
蛋白質降解
對於細胞來說,蛋白質降解有多種用途,包括去除分泌蛋白的N末端信號肽,對前體蛋白進行剪切以產生「成熟」蛋白等。
細胞不需要的或受到損傷的非跨膜蛋白質一般由蛋白酶體來進行降解,而真核生物的跨膜蛋白則通過內體運送到溶酶體
(動物細胞)或液泡(酵母)中進行降解。
降解所生成的胺基酸分子可以被用於合成新的蛋白質。一些蛋白質可以發生自降解。
此外,細胞中存在的大量蛋白酶(特別是溶酶體中),可以對外來的蛋白質進行降解,這也是一種細胞自我保護的機制。
生物學實驗中,也經常對蛋白質進行降解分析;
例如在蛋白質組學中,利用蛋白酶對特定蛋白質進行降解,並對降解產物進行質譜分析而獲得對應蛋白質的序列信息和修飾情況;
此外,生物化學實驗中,埃德曼降解法常被用於對蛋白質進行胺基酸序列分析。
蛋白質結構
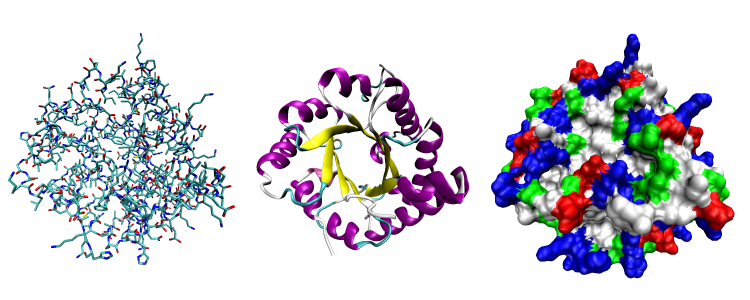
三種顯示蛋白質三維結構的方式。
圖中蛋白質為磷酸丙糖異構酶
(triose phosphate isomerase)。
左:顯示全部原子,並以原子類型標色
(碳原子為藍綠色,氧原子為紅色,氮原子為藍色);
中:只顯示主鏈構象,以二級結構類型標色
(α螺旋為紫色,β摺疊為黃色);
右:顯示「溶劑可及表面」,
以殘基類型標色(酸性胺基酸為紅色,鹼性胺基酸為藍色,極性胺基酸為綠色,非極性胺基酸為白色)。
大多數的蛋白質都自然摺疊為一個特定的三維結構,這一特定結構被稱為天然狀態。
雖然多數蛋白可以通過本身胺基酸序列的性質進行自我摺疊,但還是有許多蛋白質需要分子伴侶的幫助來進行正確的摺疊。
在高溫或極端pH等條件下,蛋白質會失去其天然結構和活性,這一現象就稱為變性。
生物化學家常常用以下四個方面來表示蛋白質的結構:
一級結構:組成蛋白質多肽鏈的線性胺基酸序列。
二級結構:依靠不同胺基酸之間的C=O和N-H基團間的氫鍵形成的穩定結構,主要為α螺旋和β摺疊。
三級結構:通過多個二級結構元素在三維空間的排列所形成的一個蛋白質分子的三維結構,是單個蛋白質分子的整體形狀。
蛋白質的三級結構大都有一個疏水核心來穩定結構,同時具有穩定作用的還有鹽橋、氫鍵和二硫鍵等。
常常可以用「摺疊」一詞來表示「三級結構」。
四級結構:用於描述由不同多肽鏈(亞基)間相互作用形成具有功能的蛋白質複合物分子的形態。
細胞色素c的NMR溶液結構,顯示了蛋白質的動態結構。
蛋白質並不完全是剛性分子。許多蛋白質在執行生物學功能時可以在多個相關結構中相互轉換。
在進行功能型結構重排時,這些相關的三級或四級結構通常被定義為不同「構象」,而這些結構之間的轉換就被稱為「構象變換」。
例如,酶的構象變換常常是由底物結合到活性位點所導致。
在溶液中,所有的蛋白質都會發生結構上的動態變化,主要表現為熱振動和與其他分子之間碰撞所導致的運動。
不同大小的蛋白質的分子表面。
從左到右依次為:
抗體(IgG)、血紅蛋白、胰島素、腺苷酸激酶和谷胺醯氨合成酶。
蛋白質可以由三級結構的不同大致分為三個主要類別:
球蛋白、纖維蛋白和膜蛋白。
幾乎所有的球蛋白都是水溶性的,
許多酶都是球蛋白;
纖維蛋白多為結構蛋白;
膜蛋白常常作為受體或分子通道,
是細胞與外界聯繫的重要介質。
要了解特定蛋白質的功能,
獲得其三級結構或四級結構可以提供重要的結構信息。
功能
蛋白質是細胞中的主要功能分子。
除了特定類別的RNA,大多數的其他生物分子都需要蛋白質來調控。
蛋白質也是細胞中含量最為豐富的分子之一;
例如,蛋白質占大腸桿菌細胞乾重的一半,
而其他大分子如DNA和RNA則只分別佔3%和20%。
在一個特定細胞或細胞類型中表達的所有蛋白被稱為對應細胞的蛋白質組。
蛋白質能夠在細胞中發揮多種多樣的功能,涵蓋了細胞生命活動的各個方面:
發揮催化作用的酶;參與生物體內的新陳代謝的調劑作用,如胰島素;一些蛋白質具有運輸代謝物質的作用,如離子泵和血紅蛋白;
發揮儲存作用,如植物種子中的大量蛋白質,就是用來萌發時的儲備;許多結構蛋白被用於細胞骨架等的形成,如肌球蛋白;
還有免疫、細胞分化、細胞凋亡等過程中都有大量蛋白質參與。
蛋白質功能發揮的關鍵在於能夠特異性地並且以不同的親和力與其他各類分子,包括蛋白質分子結合。
蛋白質結合其他分子的區域被稱為結合位點,而結合位點常常是從蛋白質分子表面下陷的一個「口袋」;
而結合能力與蛋白質的三級結構密切相關,因為結構決定了結合位點的形狀和化學性質(即結合位點周圍的胺基酸殘基的側鏈的化學性質)。
蛋白質結合的緊密性和特異性可以非常高;
例如,核糖核酸酶抑制蛋白可以與人的血管促生蛋白angiogenin以亞飛摩爾(sub-femtomolar,即<10
但卻完全不結合(解離常數>
非常微小的化學結構變化,如在結合位點的某一殘基側鏈上添加一個甲基基團,有時就可以幾乎完全破壞結合;
例如,氨醯tRNA合成酶可以分辨側鏈結構非常類似的纈氨酸和異亮氨酸,而這兩種胺基酸的差別就在於異亮氨酸的側鏈多出一個甲基。
相同的蛋白質分子結合在一起就可形成同源寡聚體或多聚體,有些多聚體可以形成纖維;
而這些形成纖維的蛋白質往往是結構蛋白,它們在單體狀態下是球蛋白,通過自結合來形成剛性的纖維。
蛋白-蛋白相互作用可以調控酶的活性和細胞周期中的各種進程,並可以使大型的蛋白質複合物得以形成,
這樣可以將參與同一生物學功能的分子結合到一起,從而提高其工作效率;
而結合所誘導的蛋白構象變化對於複雜的信號傳導網路的構建也是必不可少的。
還有一些蛋白質(如膜蛋白)可以結合或者插入到細胞膜中。
催化作用
細胞中,酶是最被廣泛了解和研究最多的蛋白質,它的特點是催化細胞中的各類化學反應。
酶的催化反應具有高度的專一性和極高的催化效率。酶在大多數與代謝和異化作用以及DNA的複製、
修復和RNA合成等相關的反應中發揮作用。
在翻譯後修飾作用中,一些酶(如激酶和磷酸酶)可以在其底物蛋白質上增加或去除特定化學基團(如磷酸基團)。
目前已知的酶催化的反應有約4000種。酶可以極大地加速其所催化的反應;
例如,與沒有酶催化的情況相比,乳清酸核苷-5'-單磷酸脫羧酶(orotate decarboxylase)的加速作用最高可達1017倍
(形象地說,在沒有酶的情況下完成反應需要七千八百萬年,而存在酶的情況下反應只需18毫秒)。
結合於酶上,並在酶的作用下發生反應的分子被稱為底物。
雖然酶分子通常含有數百個胺基酸殘基,但參與與底物結合的殘基只佔其中的一小部分,
而直接參与底物催化反應的殘基則更少(平均為3-4個殘基)。
這部分參與底物結合和催化的區域被稱為活性位點。有一些酶需要結合一些小分子(輔酶或輔因子)
才能夠有效發揮催化作用。酶的活性還可以被酶抑制劑所抑制,或被酶激活劑所提高。
變性作用
蛋白質受到酸、鹼、尿素、有機溶酶、重金屬、熱、紫外光及X-射線等物理或化學的破壞,
引起蛋白質自然之分子結構的改變,並引起生理活性的消失。
變性作用破壞了蛋白質的二級、三級、四級結構,一般不會影響其初級結構。
變性蛋白質的特性:溶解度降低、生物活性消失、不能結晶、易受蛋白脢的水解、滴定曲線改變,
因可滴定的官能基增加、-SH等基團的反應活性增加。
結構蛋白
結構蛋白能夠形成相對更為剛性的生物組分。多數結構蛋白為纖維蛋白;
膠原蛋白和彈性蛋白是結締組織(如軟骨)中關鍵的組分,而角蛋白則存在於頭髮、指甲、羽毛、蹄和一些貝殼中。
此外,肌動蛋白和微管蛋白作為單體是球狀可溶蛋白,
但一旦多聚化便形成長的剛性纖維用於組成細胞骨架,以保持細胞的大小和形態。
其他結構蛋白還包括馬達蛋白,如肌球蛋白、運動蛋白和動力蛋白,它們能夠產生動力。
這些蛋白質對於細胞能動性(特別是精子的運動)、細胞內物質運輸和細胞分裂都具有重要作用;
它們也為肌肉收縮提供動力。