 鈦是一種化學元素,化學符號Ti,原子序數22,
鈦是一種化學元素,化學符號Ti,原子序數22,
鈦(元素)
 鈦是一種化學元素,化學符號Ti,原子序數22,
鈦是一種化學元素,化學符號Ti,原子序數22,
在化學元素週期表中位於第4週期、第IVB族。
是一種銀白色的過渡金屬,其特徵為重量輕、
強度高、具金屬光澤,耐濕氯氣腐蝕。
鈦被認為是一種稀有金屬,
這是由於在自然界中其存在分散並難於提取。
但其相對豐度在所有元素中居第十位元。
鈦的礦石主要有鈦鐵礦及金紅石,
廣布於地殼及岩石圈之中。
鈦亦同時存在於幾乎所有生物、岩石、水體及土壤中。
從主要礦石中萃取出鈦需要用到克羅爾法或亨特法。
鈦最常見的化合物是二氧化鈦,可用於製造白色顏料。
其他化合物還包括四氯化鈦(TiCl4)
(作催化劑及用於製造煙幕或空中文字)及三氯化鈦(TiCl3)(用於催化聚丙烯的生產)。
發展歷史
從發現鈦元素到制得純品,歷時一百多年。而鈦真正得到利用,認識其本來的真面目,則是20世紀40年代以後的事情了。
地球表面十公里厚的地層中,含鈦達千分之六,比銅多61倍,
在地殼中的含量排第十位元(地殼中元素排行:氧、矽、鋁、鐵、鈣、鈉、鉀、鎂、氫、鈦),
隨便從地下抓起一把泥土,其中都含有千分之幾的鈦,世界上儲量超過一千萬噸的鈦礦並不稀罕。
地球上有成億噸的砂石,鈦和鋯這兩種比砂石重的礦物,就混雜在砂石中,經過海水千百萬年晝夜不停地淘洗,
把比較重的鈦鐵礦和鋯英砂礦沖在一起,在漫長的海岸邊,形成了一片一片的鈦礦層和鋯礦層。
這種礦層是一種黑色的砂子,通常有幾釐米到幾十釐米厚。
鈦礦石

鈦沒有磁性,用鈦建造的核潛艇不必擔心磁性水雷的攻擊。
鈦的屈服強度比鋼鐵要高,
而它的重量幾乎只有同體積的鋼鐵的一半,
鈦雖然稍稍比鋁重一點,它的屈服強度卻比鋁大2倍。
鈦的比強度高於鋁和鋼,比模量與鋁、鋼十分接近。
在宇宙火箭和導彈中,就大量用鈦代替鋼鐵。
極細的鈦粉,還是火箭的好燃料,所以鈦被譽為宇宙金屬,空間金屬。
鈦在高溫下極易和空氣發生反應,但熔點高達1668℃。
在常溫下,鈦不怕王水和稀硝酸腐蝕,但不耐5%以上硫酸腐蝕和7%鹽酸腐蝕。
鈦不怕常溫海水,有人曾把一塊鈦沉到海底,
五年以後取上來一看,上面粘了許多小動物與海底植物,
卻一點也沒有生銹,依舊亮閃閃的。人們開始用鈦來製造潛艇——鈦潛艇。
由於鈦非常結實,能承受很高的壓力,這種潛艇可以在深達4500米的深海中航行。
 基本資訊
基本資訊
已知的鈦的同位素有13種,包括鈦-41至鈦-53。
其中鈦的穩定同位素有鈦-46,鈦-47,鈦-48,鈦-49,
鈦-50共五種,其餘的同位素均有放射性。
鈦是一種化學元素,化學符號Ti,原子序數22,
是一種銀白色的過渡金屬,其特徵為重量輕、強度高、具金屬光澤,
亦有良好的抗腐蝕能力(包括海水、王水及氯氣)。
由於其穩定的化學性質,良好的耐高溫、耐低溫、抗強酸、抗強鹼,以及高強度、低密度,被美譽為“太空金屬”。
鈦于1791年由格雷戈爾(William Gregor)於英國康沃爾郡發現,並由克拉普羅特(Martin
Heinrich Klaproth)用希臘神話的泰坦為其命名。
鈦被認為是一種稀有金屬,這是由於在自然界中其存在分散並難於提取。但其相對豐度在所有元素中居第十位元。
鈦的礦石主要有鈦鐵礦及金紅石,廣布於地殼及岩石圈之中。鈦亦同時存在於幾乎所有生物、岩石、水體及土壤中。
從主要礦石中萃取出鈦需要用到克羅爾法[5]或亨特法。鈦最常見的化合物,二氧化鈦可用於製造白色顏料。
其他化合物還包括四氯化鈦(TiCl4)(作催化劑及用於製造煙幕或空中文字)及三氯化鈦(TiCl3)(用於催化聚丙烯的生產)。
 鈦能與鐵、鋁、釩或鉬等其他元素熔成合金,
鈦能與鐵、鋁、釩或鉬等其他元素熔成合金,
造出高強度的輕合金,在各方面有著廣泛的應用,
包括航太(噴氣發動機、導彈及航天器)、
軍事、工業程式(化工與石油製品、海水淡化及造紙)、
汽車、農產食品、醫學(義肢、骨科移植及牙科器械與填充物)、
運動用品、珠寶及手機等等。
鈦最有用的兩個特性是,抗腐蝕性,及金屬中最高的強度-重量比。
在非合金的狀態下,鈦的強度跟某些鋼相若,但卻還要輕45%。
有兩種同素異形體和五種天然的同位素,
由Ti到Ti,其中豐度最高的是Ti(73.8%)。
鈦的化學性質及物理性質和鋯相似,
這是因為兩者的價電子數目相同,並於元素週期表中同屬一族。
在地殼中,鈦的儲量僅次於鐵、鋁、鎂,居第四位。由於鈦具有熔點高、比重小、比強度高、韌性好、
抗疲勞、耐腐蝕、導熱係數低、高低溫度耐受性能好、在急冷急熱條件下應力小等特點,
其商業價值在二十世紀五十年代開始被人們認識,被應用於航空、航太等高科技領域。
隨著不斷向化工、石油、電力、海水淡化、建築、日常生活用品等行業推廣,鈦金屬日益被人們重視,
被譽為“現代金屬”和“戰略金屬”,是提高國防裝備水準不可或缺的重要戰略物資。
 衡量一個國家鈦工業規模有兩個重要指標:
衡量一個國家鈦工業規模有兩個重要指標:
海綿鈦產量和鈦材產量,
其中海綿鈦產量反映原料生產能力,
鈦材產量反映的是深加工能力。
鈦工業已形成中國、美國、獨聯體、
日本和歐洲五大生產和消費主體。
化學性質
鈦在較高的溫度下,可與許多元素和化合物發生反應。
各種元素,按其與鈦發生不同反應可分為四類:
第一類:鹵素和氧族元素與鈦生成共價鍵與離子鍵化合物;
第二類:過渡元素、氫、鈹、硼族、碳族和氮族元素與鈦生成金屬間化物和有限固溶體;
第三類:鋯、鉿、釩族、鉻族、鈧元素與鈦生成無限固溶體;
第四類:惰性氣體、鹼金屬、鹼土金屬、稀土元素(除鈧外),錒、釷等不與鈦發生反應或基本上不發生反應。
與化合物HF和氟化物氟化氫氣體在加熱時與鈦發生反應生成TiF4,
反應式為不含水的氟化氫液體可在鈦表面上生成一層緻密的四氟化鈦膜,可防止HF浸入鈦的內部。
氫氟酸是鈦的最強溶劑。即使是濃度為1%的氫氟酸,也能與鈦發生激烈反應,見式1;
無水的氟化物及其水溶液在低溫下不與鈦發生反應,僅在高溫下熔融的氟化物與鈦發生顯著反應。
Ti+4HF=TiF4+2H2+135.0千卡⑴2Ti+6HF=2TiF3+3H2
⑵ HCl和氯化物氯化氫氣體能腐蝕金屬鈦,乾燥的氯化氫在>300℃時與鈦反應生成TiCl4,見式⑶;
濃度<5%的鹽酸在室溫下不與鈦反應,20%的鹽酸在常溫下與鈦發生瓜在生成紫色的TiCl3,見式⑷;
當溫度長高時,即使稀鹽酸也會腐蝕鈦。
各種無水的氯化物,如鎂、錳、鐵、鎳、銅、鋅、汞、錫、鈣、鈉、鋇和NH4+離子及其水溶液,
都不與鈦發生反應,鈦在這些氯化物中具有很好的穩定性。
Ti+4HCl=TiCl4+2H2+94.75千卡⑶2Ti+6HCl=TiCl3+3H2
⑷硫酸和硫化氫鈦與5%的硫酸有明顯的反應,在常溫下,約40%的硫酸對鈦的腐蝕速度最快,
當濃度大於40%,達到60%時腐蝕速度反而變慢,80%又達到最快。
加熱的稀酸或50%的濃硫酸可與鈦反應生成硫酸鈦,見式⑸、⑹,
加熱的濃硫酸可被鈦還原,生成SO2,見式⑺。
常溫下鈦與硫化氫反應,在其表面生成一層保護膜,可阻止硫化氫與鈦的進一步反應。
但在高溫下,硫化氫與鈦反應析出氫,見式⑻,
粉末鈦在600℃開始與硫化氫反應生成鈦的硫化物,在900℃時反應產物主要為TiS,1200℃時為Ti2S3。
Ti+H2SO4=TiSO4+H2⑸
2Ti+3H2SO4=Ti2(SO4)3+3H2⑹
2Ti+6H2SO4=Ti2(SO4)3+3SO2+6H2O+202千卡⑺
Ti+H2S=TiS+H2+70千卡⑻
硝酸和王水 緻密的表面光滑的鈦對硝酸具有很好的穩定性,
這是由於硝酸能快速在鈦表面生成一層牢固的氧化膜,但是表面粗糙,特別是海綿鈦或粉末鈦,
可與次、熱稀硝酸發生反應,見式⑼、⑽,
高於70℃的濃硝酸也可與鈦發生反應,見式⑾;常溫下,鈦不與王水反應。
溫度高時,鈦可與王水反應生成TiCl2。 3Ti+4HNO3+4H2O=3H4TiO4+4NO⑼
3Ti+4HNO3+H2O=3H2TiO3+4NO
⑽ Ti+8HNO3=Ti(NO3)4+4NO2+4H2O
⑾
綜上所述,鈦的性質與溫度及其存在形態、純度有著極其密切的關係。
緻密的金屬鈦在自然界中是相當穩定的,但是,粉末鈦在空氣中可引起自燃。
鈦中雜質的存在,顯著的影響鈦的物理、化學性能、機械性能和耐腐蝕性能。
特別是一些間隙雜質,它們可以使鈦晶格發生畸變,而影響鈦的的各種性能。
常溫下鈦的化學活性很小,能與氫氟酸等少數幾種物質發生反應,
但溫度增加時鈦的活性迅速增加,特別是在高溫下鈦可與許多物質發生劇烈反應。
鈦的冶煉過程一般都在800℃以上的高溫下進行,因此必須在真空中或在惰性氣氛保護下操作。
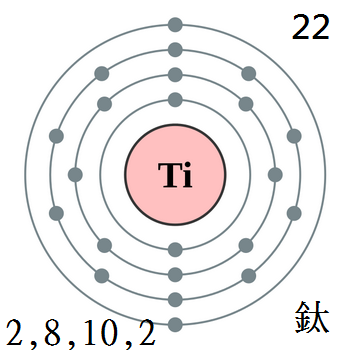
金屬鈦的物理性質金屬鈦(Ti),灰色金屬。原子序數為22,相對原子品質47.87。
核外電子在亞層中的排布情況為1S2 2S2 2P6 3S2 3P6 3d2 4S2。
金屬活動性在鎂、鋁之間,常溫下並不穩定,因此在自然界中只以化合態存在,
常見的鈦的化合物有鈦鐵礦(FeTiO3)、金紅石(TiO2)等。
鈦在地殼中含量較高,排行第九,達5600ppm,換算成百分比為0.56%。
純鈦密度為4.54×103kg/m3,摩爾體積為10.54cm3/mol,硬度較差,莫氏硬度只有4左右,因此延展性好。
鈦的熱穩定性很好,熔點為1660±10℃,沸點為3287℃。
金屬鈦的化學性質
金屬鈦在高溫環境中的還原能力極強,能與氧、碳、氮以及其他許多元素化合,
還能從部分金屬氧化物(比如氧化鋁)中奪取氧。
常溫下鈦與氧氣化合生成一層極薄緻密的氧化膜,這層氧化膜常溫下不與硝酸,稀硫酸,稀鹽酸反應,
以及酸中之王——王水。它與氫氟酸、濃鹽酸、濃硫酸反應。
元素來源
鈦屬於稀有金屬,實際上鈦並不稀有,其在地殼中的豐度占第七位,占0.45%,遠遠高於許多常見的金屬。
但由於鈦的性質活潑,對冶煉工藝要求高,使得人們長期無法制得大量的鈦,從而被歸類為“稀有”的金屬。
用於冶煉鈦的礦物主要有鈦鐵礦(FeTiO3)、金紅石(TiO2)和鈣鈦礦等。
礦石經處理得到易揮發的四氯化鈦,再用鎂還原而制得純鈦。
液態鈦幾乎能溶解所有的金屬,因此可以和多種金屬形成合金。
鈦加入鋼中制得的鈦鋼堅韌而富有彈性。鈦與金屬Al、Sb、Be、Cr、Fe等生成填隙式化合物或金屬間化合物。
鈦合金製成飛機比其它金屬製成同樣重的飛機多載旅客100多人。
製成的潛艇,既能抗海水腐蝕,又能抗深層壓力,其下潛深度比不銹鋼潛艇增加80%。
同時,鈦無磁性,不會被水雷發現,具有很好的反監護作用。
鈦具有“親生物”性。在人體內,能抵抗分泌物的腐蝕且無毒,對任何殺菌方法都適應。
因此被廣泛用於制醫療器械,制人造髖關節、膝關節、肩關節、脅關節、頭蓋骨,主動心瓣、骨骼固定夾。
當新的肌肉纖維環包在這些“鈦骨”上時,這些鈦骨就開始維繫著人體的正常活動。
鈦在人體中分佈廣泛,正常人體中的含量為每70kg體重不超過15mg,其作用尚不清楚。
但鈦能刺激吞噬細胞,使免疫力增強這一作用已被證實。