 鋇是鹼土金屬元素,
鋇是鹼土金屬元素,
鋇(化學元素)
 鋇是鹼土金屬元素,
鋇是鹼土金屬元素,
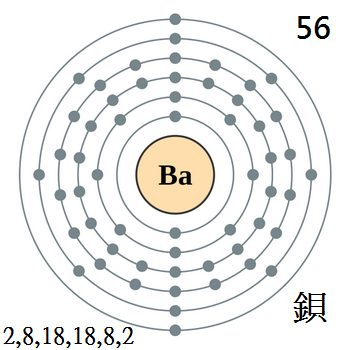
是週期表中ⅡA族的第五週期的元素,
是鹼土金屬中活潑的元素,
元素名來源於希臘文 (barys),原意是“重的”。
化學元素符號是Ba。是一種柔軟的有銀白色光澤的鹼土金屬。
由於它的化學性質十分活潑,從來沒有在自然界中發現鋇單質。
鋇在自然界中最常見的礦物是重晶石(硫酸鋇)和毒重石(碳酸鋇),
二者皆不溶于水。
鋇在1774年被確認為一個新元素,
但直到1808年電解法發明不久後才被歸納為金屬元素。
鋇的化合物用於製造煙火中的綠色(以焰色反應為原理)。
電解熔融的氯化鋇或用鋁還原氯化鋇,可制得金屬鋇。
化學性質
鋇的化學活性很大,在鹼土金屬中是最為活潑的。
從電勢以及電離能可以看出,鋇單質具有很強的還原性,事實上若只考慮失去第一個電子的情況,
鋇在水中的還原性是最強的(E⦵Ba+/Ba=-4.38V)。但鋇失去第二個電子相對困難,所以綜合考慮,鋇的還原性會下降不少。
即使如此,它也是酸性溶液中最活潑的金屬之一,僅次於鋰,銫,銣與鉀。
 鋇在空氣中緩慢氧化,生成氧化鋇,
鋇在空氣中緩慢氧化,生成氧化鋇,
燃燒時則發出綠色火焰,生成過氧化鋇。
同時鋇也會與空氣中的氮氣反應,
生成氮化鋇。
鋇與氫氣可化合為BaH2,BaH2是一種很強的還原劑。
鋇與水反應,生成氫氧化鋇與氫氣,
由於氫氧化鋇的溶解度不大,且鋇的昇華能較高,
所以反應不如鹼金屬那樣劇烈,生成的氫氧化鋇會遮蓋住視線。
鋇能溶于液氨,生成具有順磁性的、
導電的藍色溶液,其本質是形成了氨合電子:
Ba+2NH3=Ba2++2NH3·e-。
在長時間放置後,鋇可以分解氨,形成氨基鋇與氫氣。
研究歷史
鹼土金屬的硫化物具有磷光現象,
即它們受到光的照射後在黑暗中會繼續發光一段時間。
鋇的化合物正是因這一特性而開始被人們注意。
1602年義大利波羅拉(Bologna,現稱博洛尼亞)城一位制鞋工人凱西奧勞羅,
將一種含硫酸鋇的重晶石與可燃物質一起焙燒後發現它在黑暗中發光,引起了當時學者們的興趣。
後來這種石頭被稱為波羅拉石,並引起了歐洲化學家分析研究的興趣。
 1774年瑞典化學家舍勒(C.W.Scheele)
1774年瑞典化學家舍勒(C.W.Scheele)
發現氧化鋇是一種比重大的新土,
稱之為“Baryta”(重土)。
到1774年,舍勒認為這種石頭是一種新土(氧化物)
和硫酸結合成的,
1776年他加熱這一新土的硝酸鹽,
獲得純淨的土(氧化物)。
1808年英國化學家大衛(H.Davy)用汞作陰極,
鉑作陽極,電解重晶石(BaSO4)制得鋇汞齊,
經蒸餾去汞後, 得到一種純度不高的金屬,
並以希臘文barys(重)命名。
元素符號定為Ba,稱為鋇。
主要用途
金屬鋇可用作除去真空管和顯像管痕量氣體的消氣劑、精煉金屬的脫氣劑。
用於生產鋇鎳合金、鋇鈣鉛等合金.
硝酸鋇與氯酸鉀、鎂粉、松香混合,可以用來製造信號彈與煙火。
用作軸承的鉛合金含有0.5-4%的鋇。在醫藥領域,硫酸鋇用作X射線檢測的造影劑。可溶性的鋇化合物常用作殺蟲劑。
礦藏分佈
鋇,和其他鹼土金屬一樣,在地球上到處都有分佈:在地殼上部的含量是0.026%,而在地殼中的平均值是0.022%。
鋇主要以重晶石形式存在,以硫酸鹽或碳酸鹽形式存在。
自然界鋇的主要礦物為重晶石(BaSO4)和毒重石
(BaCO3)。
重晶石礦床分佈很廣,中國的湖南、廣西、山東等地都有較大的礦床。
 製備方法
製備方法
工業上制取金屬鋇分為制取氧化鋇和金屬熱還原
(鋁熱還原)兩個步驟。
在1000∼
可制得金屬鋇,再用真空蒸餾法提純。
單質鋇的製備:
1)電解熔融的BaCl2
2)在真空中用Al或Si在147K下還原BaO或BaCl2
3)鋇的氮化物熱分解。
鋁熱還原法生產金屬鋇:
因配料比不同,鋁還原氧化鋇的反應可能有兩種,反應式為:
6BaO+2Al→3BaO·Al2O3+3Ba↑
這兩種反應在1000∼
因此,必須用真空泵將鋇蒸氣不斷地從反應區轉移到冷凝區,反應才能不斷向右進行。
反應後的殘渣有毒,需經處理才能棄去。
 生理學
生理學
鋇對人類來說不是必需元素。
在這方面,對生物材料並沒有很多的資料。
鋇是有毒元素,食入可溶性鋇化合物會引起鋇中毒。
假定成年人的平均體重是70kg,他體內的鋇總量大約是
鋇劑灌腸
誤服鋇鹽後,鋇鹽會被水和胃酸溶解,
這導致了許多中毒事件和一些死亡事件的發生。
中毒症狀有嘔吐、絞痛、腹瀉、心跳變緩且不規律、
短暫的血壓升高、痙攣性的震顫和肌肉麻痹。
氯化鋇的LD50曾被假定為大約
鋇會在血漿中形成蛋白質加合物,在骨骼中沉積的鋇占鋇總量的65%。
鋇在骨骼中的半衰期大約是50天。鋇的毒性和它抑制K+離子以及它與硫酸鹽反應有關。
人注射的氯化鋇的吸收量高達60-80%,而對口服的氯化鋇的吸收量只有10-30%。
急性鋇鹽中毒症狀:
急性鋇鹽中毒臨床比較少見,多為誤服。
凡在水或稀鹽酸中可溶解的鋇化合物均具毒性,包括氯化鋇、碳酸鋇、氫氧化鋇、硝酸鋇、醋酸鋇、硫化鋇、氧化鋇等。
鋇鹽中毒主要表現為胃腸道刺激症狀和低鉀症候群,如噁心、嘔吐、腹痛、腹瀉、四肢軟癱、心肌受累、呼吸肌麻痹等。
因該類患者多有嘔吐、腹痛、腹瀉等胃腸道症狀而易誤診,集體發病時易誤診為食物中毒,單發時則易誤診為急性胃腸炎。
即使發現了低鉀血症,也常認為是嘔吐、腹瀉造成的體液鉀丟失所致,而未能引起足夠重視。
但需注意的是此類患者的低鉀血症比較嚴重,與其體液鉀丟失的量不相平行,
所以臨床上遇到原因不明的迅速發展的低鉀血症,同時有胃腸道症狀而用胃腸炎不能解釋者,
應想到有急性鋇鹽中毒的可能,可將嘔吐物或食物行毒物分析,如發現鋇鹽含量高可得到確診。
口服氯化鋇的中毒量為0.2∼
鋇中毒引起低鉀血症的可能機制:鋇中毒時,細胞膜上的Na +2K+
故細胞外液中的鉀不斷進入細胞,但鉀從細胞內流出的孔道被特異地阻斷,因而發生低鉀血症。
急性鋇鹽中毒的治療首要是洗胃,洗胃液可以選用2 %∼5 % 硫酸鎂或硫酸鈉,
解毒劑可選用硫酸鈉或硫代硫酸鈉,同時積極糾正低鉀血症,有心律失常者應用抗心律失常藥物,
呼吸困難時給予氧療,必要時人工呼吸。
http://baike.baidu.com/subview/30107/11198214.htm